题目内容
6.用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是( )| A. | 形成较多的白色沉淀 | |
| B. | 形成的沉淀纯度更高 | |
| C. | 排除Ba2+以外的其它阳离子的干扰 | |
| D. | 排除SO42-以外的其它阴离子及Ag+的干扰 |
分析 检验SO42-离子的存在时,先在待测溶液中加入盐酸,可排除银离子、碳酸根离子等干扰,后加可溶性钡盐,观察是否生成沉淀,以此来解答.
解答 解:检验SO42-离子的存在时,先在待测溶液中加入盐酸,可排除银离子、碳酸根离子等干扰,后加可溶性钡盐,观察是否生成沉淀,若生成沉淀,可证明含SO42-,反之不含,与A、B、C均无关,
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.

练习册系列答案
相关题目
9.20世纪90年代初,国际上提出了“预防污染”这一新概念.绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度的节约能源,在化工生产各环节都实现净化和无污染的反应途径.下列各项属于“绿色化学”的是( )
| A. | 处理废弃物 | B. | 治理污染物 | C. | 减少有毒物 | D. | 杜绝污染源 |
17.将1moLSO2和1moLO2通入固定容积密闭容器中,在一定条件下反应达到平衡,平衡时SO3为0.2moL,此时若移去0.5moLSO2和0.5moLO2,在同一温度下反应达到新的平衡时,SO3的物质的量是( )
| A. | 0.2moL | B. | 0.1moL | ||
| C. | 小于0.1moL | D. | 大于0.1moL,小于0.2moL |
14.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是( )
| A. | 石墨不如金刚石稳定 | |
| B. | 石墨转变成金刚石是物理变化 | |
| C. | 等质量的金刚石与石墨完全燃烧,放出的能量一样多 | |
| D. | 等质量的金刚石与石墨完全燃烧,金刚石放出的能量多 |
1.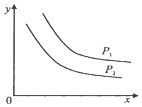 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a+1<b |
11.将一小块金属钠投入下列溶液中,既有气体放出,又有白色沉淀生成的是( )
| A. | NH4Cl溶液 | B. | 稀H2SO4溶液 | ||
| C. | 饱和FeCl3溶液 | D. | 饱和氢氧化钠溶液 |
18.下列设计的实验方案不能达到实验目的是( )
| A. | 提纯混有少量硝酸钾的氯化钠采用蒸发结晶,趁热过滤的方法 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入适量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象 | |
| D. | 用KI滴定FeCl3溶液时选用淀粉作指示剂 |
15.下列关于物质的量的表述中不正确的是( )
| A. | 1.5 mol H2O和2.5 mol水 | B. | 2 mol H2SO4 和 5 mol硫酸 | ||
| C. | 1.2 mol H2 和1.6 mol 氢 | D. | 10 mol Ne 和 12mol 氖原子 |
16.二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的Mn2+也有明显的去除效果,其反应原理为:ClO2+Mn2+→MnO2↓+Cl- (部分反应物和产物省略、未配平),下列有关该反应的说法正确的是( )
| A. | 工业上可用更为廉价的Cl2来代替ClO2 | |
| B. | 利用该原理处理含Mn2+的污水后溶液的pH升高 | |
| C. | 该反应中氧化产物和还原产物的物质的量之比为2:5 | |
| D. | 理论上处理含1mol Mn2+的污水,需要标准状况下的ClO28.96L |