题目内容
11.NA为阿伏加德罗常数,下列对0.3mol/L的K2SO4溶液的说法中,正确的是( )| A. | 1L溶液中含0.3NA个钾离子 | B. | 1L溶液中含0.9NA个离子(K+、SO42-) | ||
| C. | 2L溶液中钾离子浓度是1.2mol/L | D. | 2L溶液中含0.6 NA个离子(K+、SO42-) |
分析 A.0.3mol/L的K2SO4溶液,钾离子浓度为0.6mol/L,依据n=CV计算钾离子个数;
B.1个硫酸钾中含有2个钾离子和1个硫酸根离子;
C.0.3mol/L的K2SO4溶液,钾离子浓度为0.6mol/L,溶液具有均一性;
D.1个硫酸钾中含有2个钾离子和1个硫酸根离子.
解答 解:A.3mol/L的K2SO4溶液,钾离子浓度为0.6mol/L,则1L溶液中含1L×0.6mol/L×NA=0.6NA个钾离子,故A错误;
B.1L0.3mol/L的K2SO4溶液中含有硫酸钾是物质的量为0.3mol,含有离子个数0.3mol×2+0.3mol=0.9mol,含0.9NA个离子,故B正确;
C.0.3mol/L的K2SO4溶液,钾离子浓度为0.6mol/L,溶液具有均一性,与体积无关,所以2L溶液中钾离子浓度是0.6mol/L,故C错误;
D.2L0.3mol/L的K2SO4溶液中含有硫酸钾是物质的量为0.6mol,含有离子个数0.6mol×2+0.6mol=1.8mol,含1.8NA个离子,故D错误;
故选:B.
点评 本题考查了物质的量浓度有关计算,熟悉阿伏伽德罗常数常数的含义,明确硫酸钠结构是解题关键,注意溶液的均一性,题目难度不大.

练习册系列答案
相关题目
10.某研究小组将纯净的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图:

实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3,亚硫酸显酸性,故pH值减小;V1时,实验2中溶液pH小于实验1的原因是3SO2+2H2O+2NO3-=2NO+4H++3SO42-(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 白色沉淀生成 |

实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3,亚硫酸显酸性,故pH值减小;V1时,实验2中溶液pH小于实验1的原因是3SO2+2H2O+2NO3-=2NO+4H++3SO42-(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
| 实验步骤 | 实验现象 | 结论 |
| 实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
| 实验4: |
7.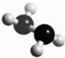 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 32g N2H4中含有共价键的总数为6NA | |
| B. | 标准状况下,22.4LH2O2中所含原子总数为4NA | |
| C. | 28g N2中含电子总数为7NA | |
| D. | 与17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
3.下列解释实验现象的反应方程式正确的是( )
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O | |
| B. | 向AgCl悬浊液中滴加NaI溶液,白色沉淀变成黄色AgCl+I-═AgI+Cl- | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
20.下列物质能使KMnO4酸性溶液褪色,不能使溴水褪色的是( )
| A. | 苯 | B. | 丙烯 | C. | 二甲苯 | D. | 己烷 |
1.提出元素周期律并根据周期律编制第一个元素周期表的科学家是( )
| A. | 道尔顿 | B. | 拉瓦锡 | C. | 门捷列夫 | D. | 阿伏加德罗 |
 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)