题目内容
20.短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示.下列说法中正确的是( )| 元素 | 甲 | 乙 | 丙 | 丁 |
| 化合价 | -2 | -3 | -4 | -3 |
| A. | 含氧酸的酸性:乙<丁 | B. | 元素非金属性:甲<乙 | ||
| C. | 丙所形成的单质可能互为同位素 | D. | 氢化物的沸点:甲>丁 |
分析 由短周期元素氢化物中甲、乙、丙、丁的化合价可知,乙、丁处于V族,甲处于ⅥA族,丙处于ⅣA,且甲、乙、丙、丁的原子半径依次增大,则甲为O元素、乙为N元素、丙为C元素、丁为P元素,结合元素周期律与元素化合物性质解答.
解答 解:由短周期元素氢化物中甲、乙、丙、丁的化合价可知,乙、丁处于V族,甲处于ⅥA族,丙处于ⅣA,且甲、乙、丙、丁的原子半径依次增大,则甲为O元素、乙为N元素、丙为C元素、丁为P元素.
A.应是最高价含氧酸的酸性:乙<丁,不是最高价含氧酸,则酸性不一定,故A错误;
B.同周期自左而右非金属性增强,故非金属性:甲(O)>乙(N),故B错误;
C.丙所形成的单质存在同素异形体,同位素研究对象为原子,故C错误;
D.水分子之间存在氢键,沸点高于PH3,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
相关题目
11.过氧化钠可与CO2作用,反应方程式为2Na2O2+2CO2=2Na2CO3+O2.当0.2mol Na2O2完全作用后,Na2CO3的质量为( )
| A. | 21.2g | B. | 21.6g | C. | 22.0g | D. | 22.4g |
8. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
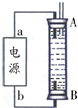
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
15.下列关于电解质说法正确的是( )
| A. | 在熔融状态或溶于水能导电的物质叫电解质 | |
| B. | 电解质在通电时发生电离 | |
| C. | 熔融的KOH导电,所以KOH是电解质 | |
| D. | NaCl晶体不导电,所以NaCl不是电解质 |
5.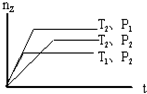 反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )
 反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,△H<0 | B. | T1<T2,P1>P2,△H>0 | ||
| C. | T1>T2,P1>P2,△H<0 | D. | T1>T2,P1<P2,△H>0 |
12.如表中括号内的物质为所含的少量杂质,请选用最佳的试剂和分离装置将杂
质除去,将对应的编号填入表中.
试剂:a水,b氢氧化钠溶液,c 溴水,d 酸性高
锰酸钾溶液,e生石灰.分离装置:A分液装置,B过滤装置,C蒸馏装置,D洗气装置.
质除去,将对应的编号填入表中.
试剂:a水,b氢氧化钠溶液,c 溴水,d 酸性高
锰酸钾溶液,e生石灰.分离装置:A分液装置,B过滤装置,C蒸馏装置,D洗气装置.
| 需加入的试剂 | 分离装置 | |
| 乙烷(乙烯) | c | D |
| 溴苯(液溴) | b | A |
| 苯(苯酚) | b | A |
| 乙醇(水) | e | C |
9.下列说法中正确的是( )
| A. | 0.1mol•L-1 H2SO4 溶液是指含有硫酸的质量为9.8 g | |
| B. | 从1L0.5mol•L-1 H2SO4溶液中取出100mL,则取出溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 取0.1mol•L-1H2SO4溶液10mL,加100mL水稀释后,H2SO4的物质的量浓度为0.01mol•L-1 | |
| D. | 150mL 1mol•L-1的NaCl溶液与75mL1mol•L-1的AlCl3溶液Cl-浓度相等 |
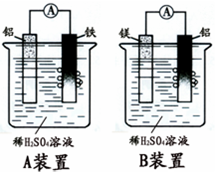 有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,
有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,