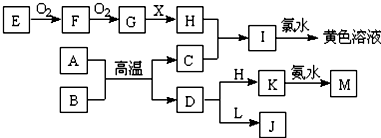
题目内容
9.下列说法中正确的是( )| A. | 0.1mol•L-1 H2SO4 溶液是指含有硫酸的质量为9.8 g | |
| B. | 从1L0.5mol•L-1 H2SO4溶液中取出100mL,则取出溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 取0.1mol•L-1H2SO4溶液10mL,加100mL水稀释后,H2SO4的物质的量浓度为0.01mol•L-1 | |
| D. | 150mL 1mol•L-1的NaCl溶液与75mL1mol•L-1的AlCl3溶液Cl-浓度相等 |
分析 A.根据m=nM=cVM计算含有硫酸的质量;
B.根据溶液为均一、稳定的分散系进行判断;
C.0.1mol•L-1H2SO4溶液10mL,加100mL水稀释后,所得溶液的体积不是100mL;
D.根据离子的物质的量浓度=溶质的物质的量浓度×溶质中含有离子的个数,与溶液的体积无关.
解答 解:A.由于溶液的体积未知,无法求出硫酸的物质的量,所以也就无法求出硫酸的质量,故A错误;
B.溶液为均一、稳定的分散系,从1L0.5mol•L-1 H2SO4溶液中取出100mL,则取出溶液的物质的量浓度应为0.5mol•L-1,故B正确;
C.取0.1mol•L-1H2SO4溶液10mL,加100mL水稀释后,所得溶液的体积不是100mL,则溶液浓度不是0.01mol•L-1,故C错误;
D.150mL 1mol•L-1的NaCl溶液中Cl-浓度为1mol•L-1,75mL 1mol•L-1的AlCl3溶液中Cl-浓度为3mol•L-1,故D错误;
故选B.
点评 本题考查物质的量浓度的相关计算,难度中等,明确物质的量浓度的概念及表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度之间的关系.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
20.短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示.下列说法中正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 化合价 | -2 | -3 | -4 | -3 |
| A. | 含氧酸的酸性:乙<丁 | B. | 元素非金属性:甲<乙 | ||
| C. | 丙所形成的单质可能互为同位素 | D. | 氢化物的沸点:甲>丁 |
4.常温下pH为2的盐酸,下列叙述正确的是( )
| A. | 该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 | |
| B. | 向该溶液中加入等体积pH为12的氨水恰好完全中和 | |
| C. | 将10mL该溶液稀释至100mL后,pH小于3 | |
| D. | 该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
14.下列同组中的两个不同反应(在溶液中进行),可用同一离子方程式表示的是( )
| A. | Na2CO3+HNO3与NaHCO3+HNO3 | B. | CaCl2+Na2CO3与Ca(NO3)2+K2CO3 | ||
| C. | Ba(OH)2+NaHSO4与BaCl2+NaHSO4 | D. | NaOH+H2SO4与Fe(OH)3+H2SO4 |
19.如图所示为某有机物的结构简式,1mol此有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为( )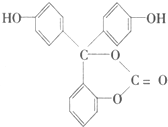

| A. | 6mol | B. | 5mol | C. | 4mol | D. | 2mol |
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.