题目内容
10.实验室常用NaOH溶液和氨水(NH3•H2O)两种碱溶液来制取不同的金属氢氧化物,请选择合适的试剂来制取以下的金属氢氧化物:(1)要制取Fe(OH)3时,可用NaOH溶液与Fe2(SO4)3或FeCl3(写化学式)反应,所得到的沉淀为红褐色,离子方程式为:Fe3++3OH-=Fe(OH)3↓.
(2)要制取Fe(OH)2时,可用NaOH溶液与FeSO4或FeCl2(写化学式)反应,所得到的沉淀为白色,离子方程式为:Fe2++2OH-=Fe(OH)2↓.
(3)要制取Cu(OH)2时,可用NaOH溶液与CuSO4或CuCl2(写化学式)反应,所得到的沉淀为蓝色,离子方程式为:Cu2++2OH-=Cu(OH)2↓.
(4)要制取Al(OH)3时,可用氨水与Al2(SO4)3或AlCl3(写化学式)反应,所得到的沉淀为白色,离子方程式为:Al3++3OH-=Al(OH)3↓.
分析 (1)氢氧化钠与可溶性铁盐反应生成氢氧化铁,氢氧化铁为红褐色沉淀;
(2)氢氧化钠与可溶性亚铁盐反应生成氢氧化亚铁,氢氧化铁为白色沉淀;
(3)氢氧化钠与可溶性铜盐反应生成氢氧化铜,氢氧化铜为蓝色沉淀;
(4)氨水与可溶性铝盐反应生成氢氧化铝,氢氧化铝为白色沉淀.
解答 解:(1)氢氧化钠与Fe2(SO4)3或FeCl3反应生成氢氧化铁,氢氧化铁为红褐色沉淀,离子方程式:Fe3++3OH-=Fe(OH)3↓;
故答案为:Fe2(SO4)3或FeCl3;红褐; Fe3++3OH-=Fe(OH)3↓;
(2)氢氧化钠与可溶性FeSO4或FeCl2反应生成氢氧化亚铁,氢氧化铁为白色沉淀,离子方程式:Fe2++2OH-=Fe(OH)2↓;
故答案为:FeSO4或FeCl2;白色;Fe2++2OH-=Fe(OH)2↓;
(3)氢氧化钠与CuSO4或CuCl2反应生成氢氧化铜,氢氧化铜为蓝色沉淀,离子方程式:Cu2++2OH-=Cu(OH)2↓;
故答案为:CuSO4或CuCl2;蓝色;Cu2++2OH-=Cu(OH)2↓;
(4)氨水与Al2(SO4)3或AlCl3反应生成氢氧化铝,氢氧化铝为白色沉淀,离子方程式:Al3++3OH-=Al(OH)3↓;
故答案为:Al2(SO4)3或AlCl3;白色;Al3++3OH-=Al(OH)3↓;
点评 本题考查了离子方程式的书写,明确复分解反应条件是解题关键,题目难度不大,注意制备氢氧化铝应用氨水,不能使用氢氧化钠.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
20.短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示.下列说法中正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 化合价 | -2 | -3 | -4 | -3 |
| A. | 含氧酸的酸性:乙<丁 | B. | 元素非金属性:甲<乙 | ||
| C. | 丙所形成的单质可能互为同位素 | D. | 氢化物的沸点:甲>丁 |
5.将物质的量之比为1:2 的甲烷和氯气混合后,在强光的照射下充分反应,生成物中物质的量最大的是( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | HCl |
2.硫酸亚铁在高温下分解的方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.若将反应所得的气体混合
物通入BaCl2溶液(已知SO3+H2O═H2SO4),将得到( )
物通入BaCl2溶液(已知SO3+H2O═H2SO4),将得到( )
| A. | BaSO3与BaSO4沉淀 | B. | BaSO3沉淀 | ||
| C. | BaSO4沉淀 | D. | 无法得到沉淀物 |
19.如图所示为某有机物的结构简式,1mol此有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为( )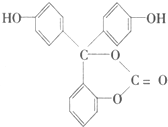

| A. | 6mol | B. | 5mol | C. | 4mol | D. | 2mol |
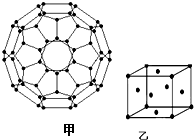 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
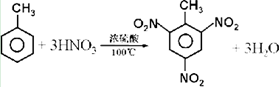 .
.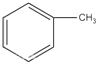 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$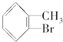 +HBr或
+HBr或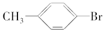 +HBr.
+HBr.