题目内容
浓硫酸在加热条件下能溶解金属银,反应的化学方程式为2Ag+2H2SO4 (浓)
Ag2SO4+SO2↑+2H2O,下列反应中浓硫酸的作用与该反应相同的是( )
| △ |
A、Cu+2H2SO4 (浓)
| ||
B、C+2H2SO4 (浓)
| ||
| C、2FeO+4H2SO4→Fe2(SO4)3+SO2↑+4H20 | ||
D、C2H5OH+2H2SO4 (浓)
|
考点:浓硫酸的性质
专题:
分析:在反应中2Ag+2H2SO4 (浓)
Ag2SO4+SO2↑+2H2O,银的化合价升高,硫的化合价部分降低,部分未变,所以浓硫酸的作用是氧化剂和酸,由此分析解答.
| △ |
解答:
解:A、在Cu+2H2SO4 (浓)
CuSO4+SO2↑+2H2O反应中,硫的化合价部分降低,部分未变,所以浓硫酸的作用是氧化剂和酸,故A正确;
B、在C+2H2SO4 (浓)
CO2↑+2SO2↑+2H2O反应中,硫的化合价全部降低,所以浓硫酸只作氧化剂,故B错误;
C、在2FeO+4H2SO4→Fe2(SO4)3+SO2↑+4H20的反应中,硫的化合价部分降低,部分未变,所以浓硫酸的作用是氧化剂和酸,故C正确;
D、C2H5OH+2H2SO4 (浓)
2C+2SO2↑+5H2O反应中,硫的化合价全部降低,所以浓硫酸只作氧化剂,故D错误;
故选:AC.
| △ |
B、在C+2H2SO4 (浓)
| △ |
C、在2FeO+4H2SO4→Fe2(SO4)3+SO2↑+4H20的反应中,硫的化合价部分降低,部分未变,所以浓硫酸的作用是氧化剂和酸,故C正确;
D、C2H5OH+2H2SO4 (浓)
| △ |
故选:AC.
点评:本题考查氧化还原反应,为高频考点,把握常见的反应及反应中元素的化合价变化为解答的关键,侧重基本概念的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
酸雨给人类带来了种种灾难,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是( )
①将煤液化或气化,获得清洁燃料
②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
③人工收集雷电作用所产生的氮的氧化物
④飞机、汽车等交通工具采用新能源,比如氢能.
①将煤液化或气化,获得清洁燃料
②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
③人工收集雷电作用所产生的氮的氧化物
④飞机、汽车等交通工具采用新能源,比如氢能.
| A、①②④ | B、①②③ |
| C、①②③④ | D、①③④ |
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )
A、 降低温度,平衡向正反应方向移动 |
B、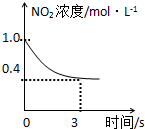 0-3s内,反应速率V (NO2)=0.2 mol?L-1 |
C、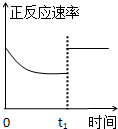 t1时仅加入催化剂,平衡正向移动 |
D、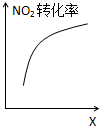 达到平衡时,仅改变X,则X为C(O2) |
下列说法正确的是( )
| A、吸热反应不加热就不会发生 |
| B、放热反应不需要加热就能发生 |
| C、键能越大表示物质内所含能量越多 |
| D、化学反应除了生成新物质外,还伴随着能量的变化 |
能正确表示下列反应的离子方程式是( )
| A、Cl2通入NaOH溶液:Cl2+OH-→Cl-+ClO-+H2O |
| B、用CH3COOH溶解CaCO3:CaCO3+2H+→Ca2++H2O+CO2↑ |
| C、Cu溶于稀HNO3:3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O |
| D、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |