题目内容
某校化学实验兴趣小组欲采用如图1所示的实验装置制Cl2,同时进行与氯气有关的某些实验,按要求回答问题.
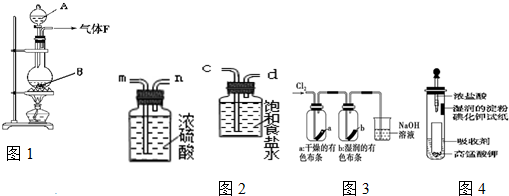
(1)药品A的名称是 ,此反应的离子方程式是 .
(2)甲同学用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下) 1.12L(填“大于”“等于”“小于”).
(3)在实验室中,乙同学欲用图2中的装置净化氯气,则气流方向是:
气体F→ → → → (填代号).
(4)把净化后的氯气通入如下(图3)装置.①观察到a不褪色,b褪色,可
得到的结论是: ;②检验吸收Cl2后的NaOH溶液中含有Cl-时,需要滴加的试剂以及现象为 .
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图4).能说明Cl2的氧化性强于I2的实验现象是: .

(1)药品A的名称是
(2)甲同学用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)
(3)在实验室中,乙同学欲用图2中的装置净化氯气,则气流方向是:
气体F→
(4)把净化后的氯气通入如下(图3)装置.①观察到a不褪色,b褪色,可
得到的结论是:
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图4).能说明Cl2的氧化性强于I2的实验现象是:
考点:氯气的实验室制法
专题:实验题
分析:(1)图1是二氧化锰与浓盐酸反应的发生装置,分液漏斗中存放的药品是浓盐酸,反应原理是:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑;
(2)随反应的进行浓盐酸变稀盐酸与二氧化锰不反应,所以实际参加反应的HCl小于0.2mol;
(3)生成的Cl2含有HCl、H2O,所以F连接c、通过饱和食盐水除去HCl、继续d连接m,通过浓硫酸,除去H2O,即可收集纯净、干燥的氯气;
(4)干燥的有色布条不褪色,而湿润的有色布条褪色,说明Cl2没有漂白性,氯水具有漂白作用;氯离子的检验滴入硝酸酸化的硝酸银溶液,观察有无白色沉淀生成;
(5)生成的氯气与试管上方的碘化钾反应生成碘单质,与淀粉变蓝,说明Cl2的氧化性强于I2.
| ||
(2)随反应的进行浓盐酸变稀盐酸与二氧化锰不反应,所以实际参加反应的HCl小于0.2mol;
(3)生成的Cl2含有HCl、H2O,所以F连接c、通过饱和食盐水除去HCl、继续d连接m,通过浓硫酸,除去H2O,即可收集纯净、干燥的氯气;
(4)干燥的有色布条不褪色,而湿润的有色布条褪色,说明Cl2没有漂白性,氯水具有漂白作用;氯离子的检验滴入硝酸酸化的硝酸银溶液,观察有无白色沉淀生成;
(5)生成的氯气与试管上方的碘化钾反应生成碘单质,与淀粉变蓝,说明Cl2的氧化性强于I2.
解答:
解:(1)图1是二氧化锰与浓盐酸反应的发生装置,分液漏斗中存放的药品是浓盐酸,反应原理是:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑,
故答案为:浓盐酸;MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑;
(2)随反应的进行浓盐酸变稀盐酸与二氧化锰不反应,所以实际参加反应的HCl小于0.2mol,所以生成标准状况下氯气小于1.12L,故答案为:小于;
(3)生成的Cl2含有HCl、H2O,所以F连接c、通过饱和食盐水除去HCl、继续d连接m,通过浓硫酸,除去H2O,即可收集纯净、干燥的氯,故答案为:c;d;m;n;
(4)①干燥的有色布条不褪色,而湿润的有色布条褪色,说明Cl2没有漂白性,氯水具有漂白作用,②氯离子的检验滴入硝酸酸化的硝酸银溶液,观察有无白色沉淀生成,故答案为:Cl2没有漂白性,氯水具有漂白作用;稀硝酸和硝酸银,有白色沉淀产生;
(5)生成的氯气与试管上方的碘化钾反应生成碘单质,与淀粉变蓝,说明Cl2的氧化性强于I2,故答案为:湿润的淀粉KI试纸变蓝.
| ||
故答案为:浓盐酸;MnO2+4H++2Cl-
| ||
(2)随反应的进行浓盐酸变稀盐酸与二氧化锰不反应,所以实际参加反应的HCl小于0.2mol,所以生成标准状况下氯气小于1.12L,故答案为:小于;
(3)生成的Cl2含有HCl、H2O,所以F连接c、通过饱和食盐水除去HCl、继续d连接m,通过浓硫酸,除去H2O,即可收集纯净、干燥的氯,故答案为:c;d;m;n;
(4)①干燥的有色布条不褪色,而湿润的有色布条褪色,说明Cl2没有漂白性,氯水具有漂白作用,②氯离子的检验滴入硝酸酸化的硝酸银溶液,观察有无白色沉淀生成,故答案为:Cl2没有漂白性,氯水具有漂白作用;稀硝酸和硝酸银,有白色沉淀产生;
(5)生成的氯气与试管上方的碘化钾反应生成碘单质,与淀粉变蓝,说明Cl2的氧化性强于I2,故答案为:湿润的淀粉KI试纸变蓝.
点评:本题考查了物质制备过程分析判断,物质性质的理解应用,和离子方程式书写方法,掌握基础是关键,题目难度较大.

练习册系列答案
相关题目
浓硫酸在加热条件下能溶解金属银,反应的化学方程式为2Ag+2H2SO4 (浓)
Ag2SO4+SO2↑+2H2O,下列反应中浓硫酸的作用与该反应相同的是( )
| △ |
A、Cu+2H2SO4 (浓)
| ||
B、C+2H2SO4 (浓)
| ||
| C、2FeO+4H2SO4→Fe2(SO4)3+SO2↑+4H20 | ||
D、C2H5OH+2H2SO4 (浓)
|
下列说法不正确的是( )
| A、使用正催化剂可降低活化能,增加反应物活化分子的百分数 |
| B、升高温度可增加反应物活化分子的百分数 |
| C、增加反应物浓度可增加反应物活化分子的百分数 |
| D、对于有气体参加的可逆反应,加压可增大单位体积反应物活化分子的数目 |
下列说法正确的是( )
| A、宏观上的物质对外不显电性,是因为组成它们的微观粒子都是电中性的原子和分子 |
| B、某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 |
| C、利用化学方法,我们可以制造出新的分子,但不能制造出新原子 |
| D、由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子 |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、pH=2的CH3COOH和pH=12的NaOH溶液等体积混合 |
| C、CH3COONa溶液 |
| D、c(NH+4)=c(Cl-)的NH4Cl和氨水的混合溶液 |
常温时,Ksp[Mg(OH)2]=1.1×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,Ksp(CH3COOAg)=2.3×10-3,下列叙述不正确的是( )
| A、在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
| B、浓度均为0.2 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| C、c(Mg2+)为0.11 mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当它们的体积比为3:2:1时,3种溶液与等物质的量浓度AgNO3溶液反应,所需AgNO3溶液的体积之比为( )
| A、1:1:1 |
| B、6:3:2 |
| C、3:2:1 |
| D、3:4:3 |