题目内容
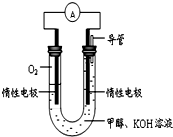 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.(1)该电池中OH-向
(2)该电池负极的电极反应为
(3)用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8gCu(OH)2固体.则原CuSO4溶液的物质的量浓度为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)原电池中阳离子向正极移动、阴离子向负极移动;
(2)该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-;
(3)加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]=
=0.1mol,相当于加入0.1molCuO和0.1molH2O,根据Cu原子守恒计算硫酸铜的物质的量浓度,根据O原子守恒、H原子守恒计算生成气体体积.
(2)该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-;
(3)加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]=
| 9.8g |
| 98g/mol |
解答:
解:(1)原电池中阳离子向正极移动、阴离子向负极移动,所以氢氧根离子向负极移动,故答案为:负;
(2)该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]=
=0.1mol,相当于加入0.1molCuO和0.1molH2O,根据Cu原子守恒得n(CuSO4)=n[Cu(OH)2]=0.1mol,则C(CuSO4)=
=0.2mol/L,
根据O原子守恒得n(O2)=n[Cu(OH)2]=0.1mol,根据H原子守恒得n(H2)=n[Cu(OH)2]=0.1mol,
则气体体积=(0.1+0.1)mol×22.4L/mol=4.48L,
故答案为:0.2mol/L;4.48L.
(2)该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]=
| 9.8g |
| 98g/mol |
| 0.1mol |
| 0.5L |
根据O原子守恒得n(O2)=n[Cu(OH)2]=0.1mol,根据H原子守恒得n(H2)=n[Cu(OH)2]=0.1mol,
则气体体积=(0.1+0.1)mol×22.4L/mol=4.48L,
故答案为:0.2mol/L;4.48L.
点评:本题考查原电池和电解池原理,侧重考查学生分析问题及计算能力,难点是电极反应式的书写,注意(3)题阴极上发生的反应有哪些,会利用原子守恒解答问题,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
下列各组物质之间不可能实现 X
Y
Z转化的是( )
| M |
| M |
| 选项 | X | Y | Z | M |
| A | C | CO | CO2 | O2 |
| B | Fe | FeCl2 | FeCl3 | Cl2 |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | NH3 | NO | NO2 | O2 |
| A、A | B、B | C、C | D、D |
P2O5不仅是一种干燥剂,而且有很强的脱水性.向浓硝酸中加入过量的P2O5,能生成一种含氮的化合物,此化合物最可能是( )
| A、N2 |
| B、NO2 |
| C、NO |
| D、N2O5 |
实验测得某些食物的近似pH如表,下列说法正确的是( )
| 食物 | 泡菜 | 葡萄 | 番茄 | 苹果 | 牛奶 | 玉米粥 |
| pH | 3.4 | 4.2 | 4.4 | 3.1 | 6.5 | 7.8 |
| A、牛奶和玉米粥均属于碱性食物 |
| B、胃酸过多的人应少食泡菜 |
| C、番茄的酸性比苹果强 |
| D、用湿润的pH试纸蘸取葡萄汁测其pH |
在N2+3H2 ?2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( )
| A、0.2mol/L?S |
| B、0.4mol/L?S |
| C、0.6mol/L?S |
| D、0.8mol/L?S |
下列说法不正确的是 ( )
| A、用100mL的容量瓶准确量取100mL液体 |
| B、分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C、用托盘天平称量NaCl固体时,NaCl放在称量纸上,称量NaOH固体时,NaOH放在小烧杯里 |
800℃时1mol焦炭和水蒸气反应生成一氧化碳和氢气,反应热△H=+131.3kJ?mol-1,它表示( )
| A、碳和水反应吸收热量131.3kJ |
| B、1mol C(s)和1mol H2O(g)反应生成一氧化碳和氢气,并吸收131.3kJ的热量 |
| C、1mol C跟1mol H2O反应吸收131.3kJ的热量 |
| D、固体碳和气态水各1mol反应,放出131.3kJ的热量 |
室温下,已知某溶液中由水电离的c(H+)和c(OH-)浓度的乘积为10-20,则该溶液中,一定不能大量共存的离子是( )
| A、S2- |
| B、NH4+ |
| C、CO32- |
| D、HCO3- |
将10.6g Na2CO3溶于水配制成1 000mL溶液,从中取出20mL,该溶液中Na+的物质的量浓度为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.05 mol?L-1 |
| D、0.025 mol?L-1 |