题目内容
在N2+3H2 ?2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( )
| A、0.2mol/L?S |
| B、0.4mol/L?S |
| C、0.6mol/L?S |
| D、0.8mol/L?S |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据v=
计算v(N2).
| △c |
| △t |
解答:
解:反应开始至2s末,氮气的浓度由0变为0.4mol?L-1,
所以v(N2)=
=0.2mol/(L?S),
故选A.
所以v(N2)=
| 0.4mol/L |
| 2s |
故选A.
点评:本题考查化学反应速率的计算,难度较小,考查学生对基础的理解,反应速率计算可用定义法或化学计量数法,根据情况选择计算方法.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
重氮甲烷(CH2N2)能与酸性物质反应:R-COOH+CH2N2→R-COOCH3+N2.下列物质中能与重氮甲烷反应但产物不是酯的是( )
| A、H-CHO |
| B、C6H5OH |
| C、C6H5CH2OH |
| D、C6H5COOH |
反应A(g)+3B(g)?2C(g)在2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是( )
| A、v(A)=0.005 mol?L-1?s-1 |
| B、v(C)=0.02 mol?L-1?s-1 |
| C、v(B)=v(A)/3 |
| D、v(A)=0.01 mol?L-1?s-1 |
下列仪器中,可用酒精灯加热的是( )
| A、集气瓶 | B、量筒 |
| C、试管 | D、分液漏斗 |
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7X+5FeSO4+12H2SO4,下列说法正确的是( )
| A、X的化学式为CuS,它既是氧化产物又是还原产物 |
| B、5 mol FeS2发生反应,有10 mol电子转移 |
| C、产物中的SO42-离子有一部分是氧化产物 |
| D、FeS2只作还原剂 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1molCl2与足量的氢氧化钠溶液反应转移的电子数为0.2 NA |
| B、12.5mL 16mol/L浓硫酸与足量铜反应,转移的电子数为0.2NA |
| C、6.2g氧化钠和7.8g过氧化钠中所含有的离子数均为0.3 NA |
| D、2.24L氯气与氢氧化钠溶液完全反应转移的电子数为0.1 NA |
 A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.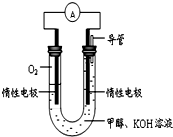 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.