题目内容
将10.6g Na2CO3溶于水配制成1 000mL溶液,从中取出20mL,该溶液中Na+的物质的量浓度为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.05 mol?L-1 |
| D、0.025 mol?L-1 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:依据n=
=cv计算溶质物质的量浓度,溶液是均一稳定的分散系,浓度和溶液体积无关,离子浓度=溶质浓度×离子数.
| m |
| M |
解答:
解:将10.6g Na2CO3溶于水配制成1 000mL溶液,溶质n=
=0.1mol,溶质物质的量浓度c=
=0.1mol/L,液是均一稳定的分散系,浓度和溶液体积无关,该溶液中Na+的物质的量浓度为0.2mol/L;
故选B.
| 10.6g |
| 106g/mol |
| 0.1mol |
| 1L |
故选B.
点评:本题考查了物质的量浓度的概念分析计算,掌握微粒浓度的计算方法是解题关键,题目较简单.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
人们利用纳米级(1~100nm,1nm=10-9m)粒子物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用.将纳米级粒子物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述不正确的是( )
| A、该分散系能产生丁达尔效应 |
| B、该分散质颗粒能透过滤纸 |
| C、该分散质颗粒能透过半透膜 |
| D、该分散质颗粒能发生布朗运动 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1molCl2与足量的氢氧化钠溶液反应转移的电子数为0.2 NA |
| B、12.5mL 16mol/L浓硫酸与足量铜反应,转移的电子数为0.2NA |
| C、6.2g氧化钠和7.8g过氧化钠中所含有的离子数均为0.3 NA |
| D、2.24L氯气与氢氧化钠溶液完全反应转移的电子数为0.1 NA |
常温常压下,1.6g O2气体的摩尔质量是( )
| A、0.05 g/mol |
| B、0.05 mol |
| C、32 g |
| D、32 g/mol |
下列反应的离子方程式中,书写正确的是( )
| A、石英溶于氢氧化钠溶液:SiO2+2OH-═SiO32-+H2O |
| B、将铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| C、铁粉与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ |
| D、金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.下列生产乙醇的反应中,原子利用率最高的是( )
A、乙烯水化:CH2=CH2+H2O
| |||
B、葡萄糖发酵:C6H12O6
| |||
C、溴乙烷水解:CH3CH2Br+H2O
| |||
D、丙酸乙酯水解:CH3CH2COOCH2CH3+H2O
|
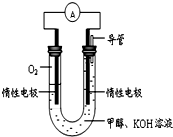 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.