题目内容
8.下列反应的离子方程式错误的是( )| A. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| C. | 过氧化钠固体与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向氢氧化钠溶液中通入足量的CO2气体:CO2+2OH-═CO32-+H2O |
分析 A.反应生成碳酸钙、碳酸钠和水;
B.反应生成碳酸钡、一水合氨、水;
C.反应生成NaOH和氧气;
D.反应生成碳酸氢钠.
解答 解:A.向碳酸氢钙溶液中加入过量氢氧化钠溶液的离子反应为Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故A正确;
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合的离子反应为Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O,故B正确;
C.过氧化钠固体与水反应的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故C正确;
D.向氢氧化钠溶液中通入足量的CO2气体的离子反应为CO2+OH-═HCO3-,故D错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
相关题目
19.下列说法中错误的是( )
| A. | SO2和SO3都是极性分子 | |
| B. | 在NH4+和H3O+中都存在配位键 | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,普遍具有熔点高硬度大的特性 |
16.下表为元素周期表中短周期元素的一部分,表中所列字母分别表示一种元素.
(1)上述元素的单质中熔点最高的可能是碳(填名称).
(2)D的氢化物比G的氢化物稳定,其原因是:碳元素的非金属性比硅的非金属强.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为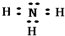 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
(4)元素C在元素周期表中位置第三周期 第IA族.
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的C、F(填字母序号)元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为N2.
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)D的氢化物比G的氢化物稳定,其原因是:碳元素的非金属性比硅的非金属强.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
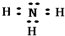 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).(4)元素C在元素周期表中位置第三周期 第IA族.
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的C、F(填字母序号)元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为N2.
3.两个容积均为1.12L的容器,在同温、同压下,一个盛满N2,另一个盛满CO气体,则两容器内气体的关系错误的是( )
| A. | 气体分子数均为3.01×1022 | B. | 密度相等 | ||
| C. | 原子数相等 | D. | 电子数相等 |
20. 我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )
我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )
 我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )
我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )| A. | 通入O2的电极发生氧化反应 | |
| B. | 通入H2的电极是正极 | |
| C. | 正极的电极反应为O2+4H++4e-═2H2O | |
| D. | 总反应的化学方程式为:O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
17.下面是一些学生的认识,其中正确的是( )
| A. | 在阴离子中,质子数一定少于核外电子数 | |
| B. | 氧化反应就是物质与氧气发生的反应 | |
| C. | 在化学反应中加入催化剂一定能加快反应的速率 | |
| D. | 最外层电子数为8的粒子一定是稀有气体元素的原子 |
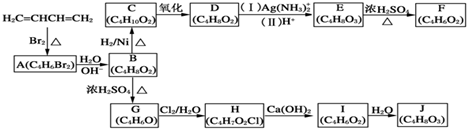
 +H2O,
+H2O,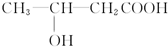 和
和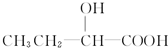 以外,还有
以外,还有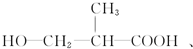 、
、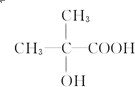 (写出结构简式,不考虑立体异构).
(写出结构简式,不考虑立体异构). ;
;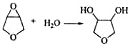 .
.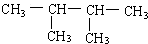 系统命名:2,3-二甲基丁烷
系统命名:2,3-二甲基丁烷
 的分子式:C4H8O
的分子式:C4H8O