题目内容
下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) |
| B、0.1mol?L-1CH3COONa溶液与0.05mol?L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) |
| C、物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+2c(OH-)=2c(H+)+c(HCN) |
| D、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)+c(Fe2+)=0.3mol?L-1 |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、任何电解质溶液中都存在电荷守恒和物料守恒;
B、0.1mol?L-1CH3COONa溶液与0.05mol?L-1盐酸等体积混合生成等物质量浓度的氯化钠和醋酸,醋酸微弱电离后溶液呈酸性,由此分析;
C、根据物料守恒和电荷守恒分析解答;
D、亚铁离子也要水解.
B、0.1mol?L-1CH3COONa溶液与0.05mol?L-1盐酸等体积混合生成等物质量浓度的氯化钠和醋酸,醋酸微弱电离后溶液呈酸性,由此分析;
C、根据物料守恒和电荷守恒分析解答;
D、亚铁离子也要水解.
解答:
解:A、任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),根据物料守恒得c(HA-)+c(A2-)+c(H2A)=c(Na+),所以得c(OH-)+c(A2-)=c(H2A)+c(H+),故A错误;
B、0.1mol?L-1CH3COONa溶液与0.05mol?L-1盐酸等体积混合生成等物质量浓度的氯化钠和醋酸,醋酸微弱电离后溶液呈酸性,c(Cl-)>c(CH3COOH)>c(H+)>c(CH3COO-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(CN-)+c(OH-),根据物料守恒得2c(Na+)=c(CN-)+c(HCN),所以得c(CN-)+2c(OH-)=2c(H+)+c(HCN),故C正确;
D.NH4+、Fe2+均发生水解,所以(NH4+)+c(NH3?H2O)+c(Fe2+)<0.3 mol?L-1,故D错误;
故选C.
B、0.1mol?L-1CH3COONa溶液与0.05mol?L-1盐酸等体积混合生成等物质量浓度的氯化钠和醋酸,醋酸微弱电离后溶液呈酸性,c(Cl-)>c(CH3COOH)>c(H+)>c(CH3COO-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(CN-)+c(OH-),根据物料守恒得2c(Na+)=c(CN-)+c(HCN),所以得c(CN-)+2c(OH-)=2c(H+)+c(HCN),故C正确;
D.NH4+、Fe2+均发生水解,所以(NH4+)+c(NH3?H2O)+c(Fe2+)<0.3 mol?L-1,故D错误;
故选C.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒、物料守恒来分析解答,题目难度中等.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、2.7g金属铝变成铝离子时,失去的电子数为0.1NA |
| B、常温常压下,NA个氮分子的质量为28g |
| C、8g甲烷中所含氢原子数为2NA |
| D、100mL2mol/L氯化铝溶液中含Cl-离子数为0.2NA |
A、B、C、D四种金属,将AB用导线连接后,浸在稀硫酸中,在A上有氢气放出,而B溶解;当活泼金属浸在含有A和C两种金属离子可溶性盐溶液里时,在活泼金属上先析出C,把D放入B的硝酸盐溶液中,则D表面有B析出.这四种金属的活动性由强到弱的顺序是( )
| A、A>B>C>D |
| B、D>B>A>C |
| C、D>C>B>A |
| D、D>B>C>A |
制备乙酸乙酯的一条合成路线为:下列说法错误的是( )
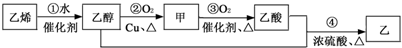

| A、乙的结构简式为CH3COOCH2CH3 | |||
| B、乙醇与CH3OCH3(二甲醚)互为同分异构体 | |||
| C、反应①属于加成反应 | |||
D、反应②的化学方程式为2CH3CH2OH+O2
|
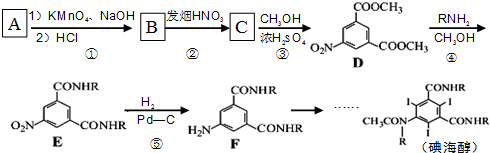
 属于α-氨基酸);
属于α-氨基酸);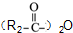 →
→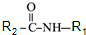 +R2COOH
+R2COOH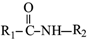 +NaOH→R1COONa+R2NH2
+NaOH→R1COONa+R2NH2 呈弱碱性,易被氧化
呈弱碱性,易被氧化 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 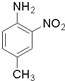 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).

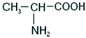
 可作为果味香精.请设计合理方案以
可作为果味香精.请设计合理方案以 、CH3CH20H为原料合成
、CH3CH20H为原料合成 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).


 ,所需溴代烃的结构简式为
,所需溴代烃的结构简式为 A、B、C、D均是前四周期元素组成的单质或化合物,它们之间有如下列转化关系:
A、B、C、D均是前四周期元素组成的单质或化合物,它们之间有如下列转化关系: