题目内容
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、6.89熔融的KHSO4中含有0.1NA个阳离子 |
| B、46 g NO2和N2O4混合气体中含有原子总数为3NA |
| C、由2H和18O所组成的水11g,其中所含的中子数为4NA |
| D、标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、熔融的硫酸氢钾中含有的阳离子只有钾离子;
B、根据NO2和N2O4的最简式计算出含有的原子总数;
C、根据2H和18O所组成的水的摩尔质量计算出11g水的物质的量及含有的中子数;
D、根据氯气和水反应是可逆的判断.
B、根据NO2和N2O4的最简式计算出含有的原子总数;
C、根据2H和18O所组成的水的摩尔质量计算出11g水的物质的量及含有的中子数;
D、根据氯气和水反应是可逆的判断.
解答:
解:A、6.8g熔融的硫酸氢钾中含有0.05mol阳离子钾离子,即含有0.05NA个阳离子,故A错误;
B、NO2和N2O4的最简式为NO2,46g混合气体中含有1mol最简式为NO2,含有原子总数为3NA,故B正确;
C、2H和18O所组成的水的摩尔质量为22g/mol,11g该水的物质的量为0.5mol,含有的中子的物质的量为6mol,所含的中子数为6NA,故C错误;
D、标况下,2.24L氯气的物质的量为0.1mol,因为氯气和水反应是可逆的,所以无法完全进行,因此转移电子少于0.1mol,而氢氧化钠中却完全反应,转移0.1mol,故D错误;
故选:B.
B、NO2和N2O4的最简式为NO2,46g混合气体中含有1mol最简式为NO2,含有原子总数为3NA,故B正确;
C、2H和18O所组成的水的摩尔质量为22g/mol,11g该水的物质的量为0.5mol,含有的中子的物质的量为6mol,所含的中子数为6NA,故C错误;
D、标况下,2.24L氯气的物质的量为0.1mol,因为氯气和水反应是可逆的,所以无法完全进行,因此转移电子少于0.1mol,而氢氧化钠中却完全反应,转移0.1mol,故D错误;
故选:B.
点评:本题考查了阿伏伽德罗常数,注意氯气与水的反应是可逆反应,不可能完全转化,本题难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
下列关于物质的量、摩尔质量的叙述中正确的是( )
| A、0.012kg12C中含有约6.02×1023个碳原子 |
| B、1molH2O中含有2 mol氢和1mol氧 |
| C、氢氧化钠的摩尔质量是40g |
| D、2mol水的摩尔质量是1mol水的摩尔质量的2倍 |
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、常温下,4gCH4含有NA个C-H共价键 |
| B、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C、含有6.02×1023个中子的D2O的质量为2.0g |
| D、1 molAl3+完全水解生成Al(OH)3胶体粒子的数目为NA |
在配制一定物质的量浓度的溶液的实验中,下列操作正确的是( )
| A、将氢氧化钠固体放在天平托盘的滤纸上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| B、将准确量取的18.4mol?L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
| C、仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 |
| D、欲配制1000mL 0.1mol?L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线 |
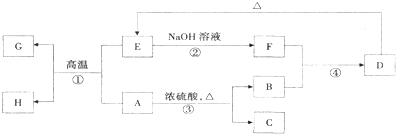
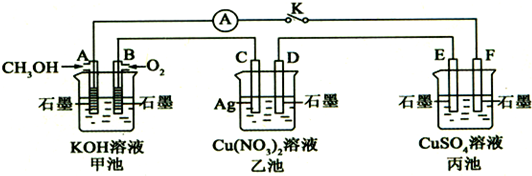
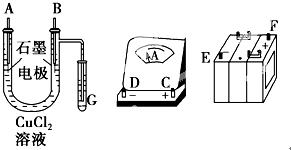 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为: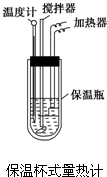 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.