题目内容
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下).其中正确的是
①pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位
②1L 0.50mol?L-1NH4Cl 溶液与2L 0.25mol?L-1NH4Cl 溶液含NH4+物质的量前者大
③pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
④pH=4、浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L( )
①pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位
②1L 0.50mol?L-1NH4Cl 溶液与2L 0.25mol?L-1NH4Cl 溶液含NH4+物质的量前者大
③pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
④pH=4、浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L( )
| A、①② | B、②③ | C、①③ | D、②④ |
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:
分析:①酸加水稀释,pH升高;
②NH4Cl 浓度越小,NH4+水解程度越大;
③NaHCO3溶液显碱性,碳酸氢根离子的水解程度大于电离程度;
④常温下,混合液pH=4,c(H+)=1.0×10-4mol/L,则由Kw可知,c(OH-)=1.0×10-10mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-),据物料守恒:2c(Na+)=c(CH3COOH)+c(CH3COO-),据此分析.
②NH4Cl 浓度越小,NH4+水解程度越大;
③NaHCO3溶液显碱性,碳酸氢根离子的水解程度大于电离程度;
④常温下,混合液pH=4,c(H+)=1.0×10-4mol/L,则由Kw可知,c(OH-)=1.0×10-10mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-),据物料守恒:2c(Na+)=c(CH3COOH)+c(CH3COO-),据此分析.
解答:
解:①酸加水稀释,pH升高,故错误;
②NH4Cl 浓度越小,NH4+水解程度越大,铵根的物质的量相同,0.25mol?L-1NH4Cl 溶液中铵根水解程度大,故正确;
③NaHCO3溶液显碱性,碳酸氢根离子的水解程度大于电离程度,其离子浓度关系为c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故错误;
④常温下,混合液pH=4,c(H+)=1.0×10-4mol/L,则由Kw可知,c(OH-)=1.0×10-10mol/L,由电荷守恒可知,Ⅰc(CH3COO-)-c(Na+)=c(H+)-c(OH-),据物料守恒:Ⅱ2c(Na+)=c(CH3COOH)+c(CH3COO-),Ⅰ×2+Ⅱ可得:c(CH3COO-)-c(CH3COOH)=2(c(H+)-c(OH-))=2×(10-4-10-10) mol/L,故正确;
故选D.
②NH4Cl 浓度越小,NH4+水解程度越大,铵根的物质的量相同,0.25mol?L-1NH4Cl 溶液中铵根水解程度大,故正确;
③NaHCO3溶液显碱性,碳酸氢根离子的水解程度大于电离程度,其离子浓度关系为c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故错误;
④常温下,混合液pH=4,c(H+)=1.0×10-4mol/L,则由Kw可知,c(OH-)=1.0×10-10mol/L,由电荷守恒可知,Ⅰc(CH3COO-)-c(Na+)=c(H+)-c(OH-),据物料守恒:Ⅱ2c(Na+)=c(CH3COOH)+c(CH3COO-),Ⅰ×2+Ⅱ可得:c(CH3COO-)-c(CH3COOH)=2(c(H+)-c(OH-))=2×(10-4-10-10) mol/L,故正确;
故选D.
点评:本题考查盐类水解及酸性的比较、pH与酸的稀释等,注意水解规律中越稀越水解来分析解答,综合性较大,题目难度中等.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
化学与能源开发、环境保护、资源利用等密切相关,下列说法正确的是( )
| A、为提高农作物的产量和质量,应大量使用化肥和农药 |
| B、装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 |
| C、氯气本身有毒,可以直接杀死水中的细菌和病毒,所以液氯可用于自来水的消毒剂 |
| D、棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O |
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应.下列说法正确的是( )
| A、当溶液中c(CH3COO-)=c (Na+)>c (H+)=c(OH-)时,一定是醋酸过量 |
| B、当溶液中c (CH3COO-)=c (Na+)时,一定是氢氧化钠过量 |
| C、当溶液中c (CH3COO-)=c (Na+)时,醋酸与氢氧化钠恰好完全反应 |
| D、当溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,一定是氢氧化钠过量 |
下列说法不正确的是( )
| A、常温下,体积相等、pH=3的盐酸和醋酸,中和NaOH溶液的能力,盐酸小于醋酸 | ||
B、 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与率起始时两物质的物质的量之比
| ||
C、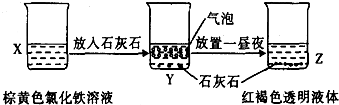 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3CO2↑+3Ca2+ | ||
D、在25℃时,将amo1?L-l的氨水与0.01 moI?L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
|
将Q和R加入到密闭体系中,在一定条件下发生反应3Q(s)+R(g)?2W(g).平衡时W的体积分数随温度和压强的变化如下表所示:下列说法正确的是( )
| 1MPa | 2MPa | 3MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)<K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |
反应过程中固体物质质量增加的是 ( )
| A、氨气通过无水氯化钙粉末 |
| B、氢气通过灼热的氧化铜粉末 |
| C、铝与氧化铁发生铝热反应 |
| D、将锌粒投入到硝酸铜溶液中 |
 元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
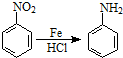 .2CH3CHO
.2CH3CHO