题目内容
在酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+).请根据题目要求填空:
(1)写出在酸性条件下,KIO3溶液与KI溶液反应的离子方程式 ,并用双线桥表示其电子转移情况.
(2)在酸性条件下(足量),各取1L浓度为1mol?L-1的KI溶液,分别与上述列举的三种溶液进行完全反应,则需要溶质的物质的量之比:n(KIO3):n(H2O2):n(FeCl3)= : : .
(1)写出在酸性条件下,KIO3溶液与KI溶液反应的离子方程式
(2)在酸性条件下(足量),各取1L浓度为1mol?L-1的KI溶液,分别与上述列举的三种溶液进行完全反应,则需要溶质的物质的量之比:n(KIO3):n(H2O2):n(FeCl3)=
考点:氧化还原反应的电子转移数目计算,氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)酸性条件下,KIO3溶液与KI溶液发生反应生成I2;
氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目;
(2)1molH2O2完全反应生成2molH2O,电子转移为2mol,同理:1molKIO3完全反应生成0.5molI2,电子转移为5mol;1molFeCl3完全反应生成1molFe2+,电子转移为1mol;1molKI完全反应生成I2,电子转移为1mol.故1L浓度为1mol?L-1的KI溶液完全反应分别需要H2O20.5mol,KIO30.2mol,FeCl31mol.
氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目;
(2)1molH2O2完全反应生成2molH2O,电子转移为2mol,同理:1molKIO3完全反应生成0.5molI2,电子转移为5mol;1molFeCl3完全反应生成1molFe2+,电子转移为1mol;1molKI完全反应生成I2,电子转移为1mol.故1L浓度为1mol?L-1的KI溶液完全反应分别需要H2O20.5mol,KIO30.2mol,FeCl31mol.
解答:
解:(1)酸性条件下,KIO3溶液与KI溶液发生反应生成I2,离子方程式为:IO3-+5I-+6H+=3I2+3H2O;根据元素化合价的变化,可得该反应电子转移的方向和数目如下所示: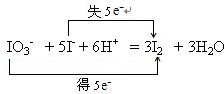 ,
,
故答案为:IO3-+5I-+6H+=3I2+3H2O; ;
;
(2)1molH2O2完全反应生成2molH2O,电子转移为2mol,同理:1molKIO3完全反应生成0.5molI2,电子转移为5mol;1molFeCl3完全反应生成1molFe2+,电子转移为1mol;1molKI完全反应生成I2,电子转移为1mol.故1L浓度为1mol?L-1的KI溶液完全反应分别需要H2O20.5mol,KIO30.2mol,FeCl31mol,故n(KIO3):n(H2O2):n(FeCl3)=0.2:0.5:1=2:5:10,
故答案为:2;5;10.
 ,
,故答案为:IO3-+5I-+6H+=3I2+3H2O;
 ;
;(2)1molH2O2完全反应生成2molH2O,电子转移为2mol,同理:1molKIO3完全反应生成0.5molI2,电子转移为5mol;1molFeCl3完全反应生成1molFe2+,电子转移为1mol;1molKI完全反应生成I2,电子转移为1mol.故1L浓度为1mol?L-1的KI溶液完全反应分别需要H2O20.5mol,KIO30.2mol,FeCl31mol,故n(KIO3):n(H2O2):n(FeCl3)=0.2:0.5:1=2:5:10,
故答案为:2;5;10.
点评:本题考查离子方程式的书写、氧化还原反应的特征和实质以及氧化还原反应得失电子数的计算,难度中等.

练习册系列答案
相关题目
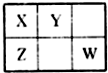 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法正确的是( )| A、Y位于第二周期第ⅣA族 |
| B、非金属性:Y>Z>X |
| C、原子半径:Z>Y>X |
| D、X、W的氢化物相遇会产生白烟 |
 单质硼有无定形和晶体两种,参考下列数据.
单质硼有无定形和晶体两种,参考下列数据.