题目内容
15.有一包白色粉末状混合物,可能含有K2CO3、CuSO4、AlCl3、NaOH中的某几种,现进行如下实验:①将混合物溶于水,得到无色透明溶液.
②取少量上述溶液两份:
第一份中加入稀硝酸,开始出现白色沉淀,有气泡产生,继续加入稀硝酸,沉淀全部溶解,再加入AgNO3溶液,又出现白色沉淀;
第二份进行焰色反应,直接观察,火焰呈黄色.
根据上述实验现象回答:
(1)原混合物中肯定有K2CO3、AlCl3、NaOH.
(2)第一份中,继续加入稀硝酸,沉淀全部溶解的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(3)第一份中,再加入AgNO3溶液,又出现白色沉淀的离子方程式为Ag++Cl-=2AgCl↓.
(4)第二份进行焰色反应,为什么观察不到K+的焰色反应.Na+火焰呈黄色,会对K+的检验造成干扰(或未透过钴玻璃观察).
分析 ①将混合物溶于水,得到无色透明溶液,则原混合物中一定不存在CuSO4;
②取少量上述溶液两份:第一份中加入稀硝酸,开始出现白色沉淀,有气泡产生,继续加入稀硝酸,沉淀全部溶解,说明反应后溶液中含有偏铝酸根离子,则原混合物中含有AlCl3、NaOH;生成气体为二氧化碳,则一定含有K2CO3;再加入AgNO3溶液,又出现白色沉淀,进一步证明原混合物中含有氯化铝;
第二份进行焰色反应,直接观察,火焰呈黄色,证明溶液中含有钠离子,据此进行解答.
解答 解:(1)①将混合物溶于水,得到无色透明溶液,则原混合物中一定不存在CuSO4;
②取少量上述溶液两份:第一份中加入稀硝酸,开始出现白色沉淀,有气泡产生,继续加入稀硝酸,沉淀全部溶解,说明反应后溶液中含有偏铝酸根离子,则原混合物中含有AlCl3、NaOH;生成气体为二氧化碳,则一定含有K2CO3;再加入AgNO3溶液,又出现白色沉淀,进一步证明原混合物中含有AlCl3,
故答案为:K2CO3、AlCl3、NaOH;
(2)第一份中,开始滴入稀硝酸时生成了氢氧化铝沉淀,之后继续加入稀硝酸,氢氧化铝与稀硝酸反应生成硝酸铝和水,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)第一份中,再加入AgNO3溶液,又出现白色沉淀,该沉淀为氯化银,反应的离子方程式为:Ag++Cl-=2AgCl↓,故答案为:Ag++Cl-=2AgCl↓;
(4)由于溶液中含有钾离子和钠离子,而Na+火焰呈黄色,会对K+的检验造成干扰,应该透过钴玻璃观察钾离子的焰色反应,
故答案为:Na+火焰呈黄色,会对K+的检验造成干扰(或未透过钴玻璃观察).
点评 本题考查了物质检验与鉴别方案的设计,题目难度中等,明确常见元素及其化合物性质为解答关键,注意常见离子的检验方法,试题培养了学生的分析能力及化学实验能力.

| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 氧化产物与还原产物的质量之比为1:1 | |
| C. | 生成3mol水时有1mol KIO3被氧化 | |
| D. | 1mol KIO3参加反应时有5mol电子转移 |
下列叙述正确的是( )
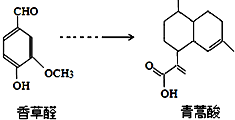
| A. | 青蒿酸分子中含有4个手性碳原子 | |
| B. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸 |
| A. | 氢氧化钠溶液 | B. | 稀硫酸 | C. | 盐酸 | D. | 稀硝酸 |
 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.下列根据实验事实得出的结论正确的是( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.下列根据实验事实得出的结论正确的是( )| A. | 取样溶于水,有白色沉淀产生,说明原白色固体中一定有Na2SO4和BaCl2 | |
| B. | 取样溶于水,静置后测得上层清液的pH>7,说明原白色固体中一定有NaOH | |
| C. | 取样溶于水,有白色沉淀产生,过滤后向沉淀中滴加盐酸,沉淀的量与加入盐酸体积的关系如图1所示,则原白色固体中无Na2SO4 | |
| D. | 取样溶于水,有白色沉淀产生,过滤后向沉淀中滴加盐酸,产生气体的量与加入盐酸体积的关系如图2所示,则该白色固体中无NaOH |
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | HF、HCl、HBr、HI水溶液的酸性依次升高 | |
| C. | 乙醇易溶于水,是因为乙醇分子与水分子之间只存在范德华力 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |

| A. | 用图甲所示方法检查装置的气密性 | |
| B. | 乙图装置可用于吸收HCl气体,并防止倒吸 | |
| C. | 大理石和稀硫酸反应制CO2时选用丙图装置 | |
| D. | 用丁图所示装置将溶液定容到100mL |
| A. | 加H2O | B. | 通入CO2 | C. | 通入SO2 | D. | 加少量NaOH |
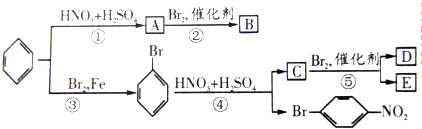
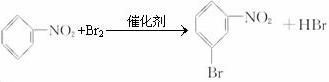 、
、 、
、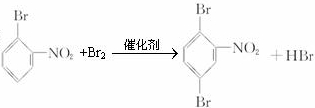 或
或 .
.