题目内容
1.在酸性溶液中,能大量共存的离子组是( )| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ca2+、NO3-、OH- |
分析 A.铁离子与硫氰根离子反应生成硫氰化铁;
B.四种离子之间不反应,都不与氢离子反应;
C.碳酸氢根离子与酸性溶液中的氢离子反应;
D.钙离子与氢氧根离子反应,氢氧根离子与酸性溶液反应.
解答 解:A.Fe3+、SCN-之间反应生成络合物硫氰化铁,在溶液中不能大量共存,故A错误;
B.Al3+、Fe2+、Cl-、SO42-之间不发生反应,都不与酸性溶液中的氢离子反应,在溶液中能够大量共存,故B正确;
C.HCO3-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故C错误;
D.酸性溶液中存在氢离子,Ca2+、OH-都与OH-之间反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
20.根据生活经验,判断下列物质按酸碱性的一定顺序依次排列正确的是( )
| A. | 厕所清洁剂、厨房清洁剂、醋、肥皂 | B. | 醋、厕所清洁剂、肥皂、厨房清洁剂 | ||
| C. | 厕所清洁剂、醋、肥皂、厨房清洁剂 | D. | 厨房清洁剂、醋、肥皂、厕所清洁剂 |
12.常温下,加水冲稀时c(H+)/c(OH-)的值明显减小的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、CH3COO- ②K+、Fe2+、I-、SO42-
③Ba2+、Cl-、NO3-、Na+ ④Na+、Ca2+、Cl-、HCO3-
⑤K+、SO42-、Cl-、NO3-.
①K+、Cl-、NO3-、CH3COO- ②K+、Fe2+、I-、SO42-
③Ba2+、Cl-、NO3-、Na+ ④Na+、Ca2+、Cl-、HCO3-
⑤K+、SO42-、Cl-、NO3-.
| A. | ② | B. | ①③⑤ | C. | ②④ | D. | ②③⑤ |
16.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
6.关于反应KIO3+6HI═3I2+KI+3H2O的说法正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 氧化产物与还原产物的质量之比为1:1 | |
| C. | 生成3mol水时有1mol KIO3被氧化 | |
| D. | 1mol KIO3参加反应时有5mol电子转移 |
10.等物质的量的下列物质与足量的铝反应,放出氢气最多的是( )
| A. | 氢氧化钠溶液 | B. | 稀硫酸 | C. | 盐酸 | D. | 稀硝酸 |
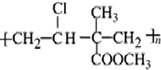 ,其单体为:CH2=CHCl、CH2=C(CH3)COOCH3.
,其单体为:CH2=CHCl、CH2=C(CH3)COOCH3. 将漫射日光照射到装有氯气和甲烷混合气体(体积比4:1)的装置上.
将漫射日光照射到装有氯气和甲烷混合气体(体积比4:1)的装置上.