题目内容
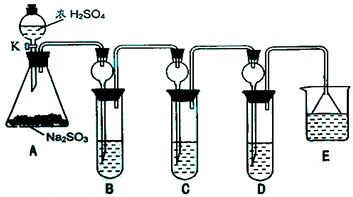 某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.
某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.(1)在B中检验SO2的氧化性,则B中所盛试剂可为
(2)在C中装FeCl3,溶液,检验SO2的还原性,则C中反应的离子方程式为
(3)在D中装新制漂白粉浓溶液.通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分进行了探究.请回答下列问题:
限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol?L-1 HCl、0.5mol?L-1 H2SO4、0.5mol?L-1BaCl2、品红溶液、新制澄清石灰水.
(1)所设一:该白色沉淀为CaSO3
假设二:该白色沉淀为
假设三:该白色沉淀为上述两种物质的混合物.
(ii)基于假设一,在答题卡上填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤、洗涤干净备用. | / |
| 用另一干净试管取少量沉淀样品,加入 |
考点:性质实验方案的设计,二氧化硫的化学性质
专题:实验设计题
分析:(1)根据氧化还原反应的规律,元素化合价降低发生还原反应,具有氧化性,据此解答;
(2)铁离子具有氧化性,能和二氧化硫发生氧化还原反应,据此书写离子方程式;
(3)(i)新制漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化亚硫酸根离子;
(ii)因沉淀的表面有可溶性的杂质,需用蒸馏水重复洗涤;亚硫酸钙和盐酸反应生成二氧化硫,二氧化硫具有漂白性,可使品红褪色;
(iii)漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化+4价的硫,据此书写化学方程式.
(2)铁离子具有氧化性,能和二氧化硫发生氧化还原反应,据此书写离子方程式;
(3)(i)新制漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化亚硫酸根离子;
(ii)因沉淀的表面有可溶性的杂质,需用蒸馏水重复洗涤;亚硫酸钙和盐酸反应生成二氧化硫,二氧化硫具有漂白性,可使品红褪色;
(iii)漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化+4价的硫,据此书写化学方程式.
解答:
解:(1)硫化氢水溶液或硫化钠、硫氢化钠溶液中的硫元素都为-2价,与二氧化硫反应,化合价会升高,被氧化二氧化硫表现氧化性,如:2H2S+SO2=3S+2H2O中,H2S中S元素的化合价升高,被氧化,SO2中S元素的化合价降低,被还原,SO2为氧化剂,
故答案为:硫化氢水溶液(或硫化钠、硫氢化钠溶液);
(2)铁离子具有氧化性,能和二氧化硫发生氧化还原反应,铁离子被还原为亚铁离子,二氧化硫被氧化为硫酸根离子,即2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
(3)(i)新制漂白粉浓溶液中含有的次氯酸根离子具有强氧化性,二氧化硫具有还原性,会发生氧化还原反应,生成产物为硫酸钙,
故答案为:CaSO4;
(ii)白色沉淀表面有钙离子和氯离子、硫酸根离子等可溶性的离子,需除去这些离子,方法是沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2~3次以上操作;亚硫酸钙和盐酸反应CaSO3+2HCl═CaCl2+SO2↑+H2O,二氧化硫与品红化合生成无色物质,能使品红溶液褪色;
故答案为:
(iii)漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化+4价的硫,所以生成该白色沉淀的化学方程式:Ca(ClO)2+H2O+SO2=CaSO4+2HCl,
故答案为:Ca(ClO)2+H2O+SO2=CaSO4+2HCl.
故答案为:硫化氢水溶液(或硫化钠、硫氢化钠溶液);
(2)铁离子具有氧化性,能和二氧化硫发生氧化还原反应,铁离子被还原为亚铁离子,二氧化硫被氧化为硫酸根离子,即2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
(3)(i)新制漂白粉浓溶液中含有的次氯酸根离子具有强氧化性,二氧化硫具有还原性,会发生氧化还原反应,生成产物为硫酸钙,
故答案为:CaSO4;
(ii)白色沉淀表面有钙离子和氯离子、硫酸根离子等可溶性的离子,需除去这些离子,方法是沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2~3次以上操作;亚硫酸钙和盐酸反应CaSO3+2HCl═CaCl2+SO2↑+H2O,二氧化硫与品红化合生成无色物质,能使品红溶液褪色;
故答案为:
| 实验操作 | 预期现象和结论 |
| 过(适)量0.5 mol?L-1HCl,塞上带导管的单孔塞,将导管另一端插入取有少量澄清石灰水(品红溶液中)的试管 | 若固体完全溶解,有气泡放出、且澄清石灰水变浑浊(或品红溶液退色)则假设一成立; 若固体不溶解,或者溶解但无气泡放出,或澄清石灰水未变浑浊(品红不退色),则假设一不成立. |
故答案为:Ca(ClO)2+H2O+SO2=CaSO4+2HCl.
点评:本题主要考查了探究SO2的化学性质实验操作,掌握实验的原理及二氧化硫的性质是解题的关键,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
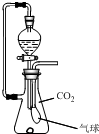 在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )
在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )| A、NaOH与Na2CO3 |
| B、Na2CO3 |
| C、Na2CO3与NaHCO3 |
| D、NaHCO3 |
下列关于氨碱法(索氏)和联合制碱法(侯氏)说法错误的是( )
| A、两者的原料来源相同 |
| B、两者的生产原理相同 |
| C、两者对食盐利用率不同 |
| D、两者最终产品都是Na2CO3 |
污水处理厂检测出一批污水中含有较多的重金属Ag+,欲将其除去,应加入适量的( )
| A、NaCl |
| B、BaSO4 |
| C、Al2O3 |
| D、HNO3 |
下列实验方案设计合理且能达到相应实验预期目的是( )
A、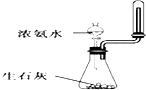 制取少量氨气 |
B、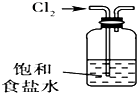 除去氯气中的HCl杂质 |
C、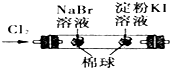 证明氧化性Cl2>Br2>I2 |
D、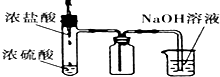 制取HCl且除去多余的气体 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的( )
| A、CaCO3(s) |
| B、Na2SO4溶液 |
| C、KNO3溶液 |
| D、CuSO4(s) |