题目内容
“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.
(1)“84”消毒液显碱性,原因是发生水解反应:ClO-+H2O?HClO+OH-.
①该反应的平衡常数表达式K= ;25℃时某“84”消毒液pH为10,35℃时pH为11,则温度升高,K (填“增大”、“不变”或“减小”).
②测定“84”消毒液的pH,应该选用 .
A.干燥的pH试纸 B.用蒸馏水湿润的pH试纸 C.pH计(或酸度计)
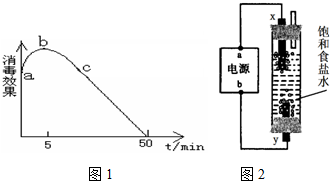
(2)在烧杯中盛放25mL某浓度的“84”消毒液,在光照下对其消毒效果的变化进行探究,实验结果如图1所示.
①a-b段导致消毒效果增大的主要反应是: .
②b-c段导致消毒效果减弱的主要反应是: .
(3)有一则报道称:有人在清洗卫生间时,因为把“84”消毒液和某清洁剂(含盐酸)混合使用,发生了中毒事故.原因是 .
(4)利用如图2所示装置和试剂可以制得少量“84”消毒液.
①a电极的名称是 .
②y电极的反应式为 .
(5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测的体系压强升高,简述该反应的平衡常数与温度的变化关系: .

(1)“84”消毒液显碱性,原因是发生水解反应:ClO-+H2O?HClO+OH-.
①该反应的平衡常数表达式K=
②测定“84”消毒液的pH,应该选用
A.干燥的pH试纸 B.用蒸馏水湿润的pH试纸 C.pH计(或酸度计)
(2)在烧杯中盛放25mL某浓度的“84”消毒液,在光照下对其消毒效果的变化进行探究,实验结果如图1所示.
①a-b段导致消毒效果增大的主要反应是:
②b-c段导致消毒效果减弱的主要反应是:
(3)有一则报道称:有人在清洗卫生间时,因为把“84”消毒液和某清洁剂(含盐酸)混合使用,发生了中毒事故.原因是
(4)利用如图2所示装置和试剂可以制得少量“84”消毒液.
①a电极的名称是
②y电极的反应式为
(5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测的体系压强升高,简述该反应的平衡常数与温度的变化关系:
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
考点:化学平衡常数的含义,电解原理,氯、溴、碘及其化合物的综合应用
专题:元素及其化合物
分析:(1)①水解平衡常数表达式K=
;根据温度对水解平衡的影响分析;
②“84”消毒液具有漂白性,能使有色物质变色,据此分析;
(2)①根据次氯酸和碳酸的酸性大小比较;
②根据次氯酸的稳定性判断;
(3)次氯酸有强氧化性,能和盐酸反应生成氯气;
(4)先根据题图象判断电解池的阴阳极,再判断电源的正负极,由溶液中离子的放电顺序判断y电极上的电极反应式;
(5)反应达到平衡状态,测的体系压强升高,说明体系温度升高,则正反应为放热反应.
| c(HClO)?c(OH-) |
| c(ClO-) |
②“84”消毒液具有漂白性,能使有色物质变色,据此分析;
(2)①根据次氯酸和碳酸的酸性大小比较;
②根据次氯酸的稳定性判断;
(3)次氯酸有强氧化性,能和盐酸反应生成氯气;
(4)先根据题图象判断电解池的阴阳极,再判断电源的正负极,由溶液中离子的放电顺序判断y电极上的电极反应式;
(5)反应达到平衡状态,测的体系压强升高,说明体系温度升高,则正反应为放热反应.
解答:
解:(1)①水解平衡常数表达式K=
;升高温度,PH增大,氢氧根离子的浓度增大,次氯酸的浓度增大,次氯酸根离子的浓度减小,所以K增大,
故答案为:
;增大;
②“84”消毒液具有漂白性,能使有色物质褪色.
A.“84”消毒液具有漂白性,能使干燥的pH试纸褪色,故A错误;
B.“84”消毒液具有漂白性,能使用蒸馏水湿润的pH试纸褪色,故B错误;
C.“84”消毒液不改变pH计(或酸度计),故C正确;
故答案为:C;
(2)①次氯酸是比碳酸还弱的酸,次氯酸钠和二氧化碳、水反应生成次氯酸和碳酸钠2ClO-+CO2+H2O=2HClO+CO32-,增大了次氯酸的浓度而使消毒效果增大,
故答案为:2ClO-+CO2+H2O=2HClO+CO32-等;
②次氯酸不稳定,在光照下能分解生成氯化氢和氧气2HClO
2HCl+O2↑,降低次氯酸的浓度,所以消毒效果降低,
故答案为:2HClO
2HCl+O2↑;
(3)次氯酸钠具有强氧化性,盐酸有还原性,次氯酸钠能和盐酸发生氧化还原反应生成氯气,氯气有毒,所以把“84”消毒液和某清洁剂(含盐酸)混合使用会发生中毒事故,
故答案为:NaClO和HCl反应生成Cl2或ClO-+Cl-+2H+=Cl2↑+H2O;
(4)①由图2知,装置和试剂可以制得少量“84”消毒液,如果是x电极产生氯气,氯气会从导管口导出,从而得不到消毒液,所以只能是y电极产生氯气,即y电极为阳极,x电极为阴极,所以a为负极,b为正极,故答案为:负极;
②y为阳极,阳极上失电子发生氧化反应,溶液中氯离子的放电能力大于氢氧根离子的放电能力,所以氯离子在阳极上放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(5)对于2A(g)+B(g)?2C(g)+D(s)反应来说,反应达到平衡时,气体的物质的量减小,如在同温下,压强应减小,但压强增大,说明温度升高,则正反应为放热反应,升高温度,平衡常数减小.
故答案为:K随温度升高而降低.
| c(HClO)?c(OH-) |
| c(ClO-) |
故答案为:
| c(HClO)?c(OH-) |
| c(ClO-) |
②“84”消毒液具有漂白性,能使有色物质褪色.
A.“84”消毒液具有漂白性,能使干燥的pH试纸褪色,故A错误;
B.“84”消毒液具有漂白性,能使用蒸馏水湿润的pH试纸褪色,故B错误;
C.“84”消毒液不改变pH计(或酸度计),故C正确;
故答案为:C;
(2)①次氯酸是比碳酸还弱的酸,次氯酸钠和二氧化碳、水反应生成次氯酸和碳酸钠2ClO-+CO2+H2O=2HClO+CO32-,增大了次氯酸的浓度而使消毒效果增大,
故答案为:2ClO-+CO2+H2O=2HClO+CO32-等;
②次氯酸不稳定,在光照下能分解生成氯化氢和氧气2HClO
| ||
故答案为:2HClO
| ||
(3)次氯酸钠具有强氧化性,盐酸有还原性,次氯酸钠能和盐酸发生氧化还原反应生成氯气,氯气有毒,所以把“84”消毒液和某清洁剂(含盐酸)混合使用会发生中毒事故,
故答案为:NaClO和HCl反应生成Cl2或ClO-+Cl-+2H+=Cl2↑+H2O;
(4)①由图2知,装置和试剂可以制得少量“84”消毒液,如果是x电极产生氯气,氯气会从导管口导出,从而得不到消毒液,所以只能是y电极产生氯气,即y电极为阳极,x电极为阴极,所以a为负极,b为正极,故答案为:负极;
②y为阳极,阳极上失电子发生氧化反应,溶液中氯离子的放电能力大于氢氧根离子的放电能力,所以氯离子在阳极上放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(5)对于2A(g)+B(g)?2C(g)+D(s)反应来说,反应达到平衡时,气体的物质的量减小,如在同温下,压强应减小,但压强增大,说明温度升高,则正反应为放热反应,升高温度,平衡常数减小.
故答案为:K随温度升高而降低.
点评:本题考查了化学平衡常数、原电池和电解池等知识点,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意化学平衡常数只有温度有关,与浓度无关.

练习册系列答案
相关题目
化学平衡常数K、弱电解质的电离平衡常数Ka或Kb及溶度积常数Ksp是高中化学中常见的几种常数.它们都能反映相应的可逆变化进行的程度,下列关于以上常数的说法正确的是( )
| A、对于可逆反应,若改变条件使平衡右移,则到达新的平衡时的平衡常数K一定增大 |
| B、一定温度下,在a mol?L-1的饱和石灰水中加入适量的b mol?L-1 CaCl2溶液(b>a),则一定有Ca(OH)2析出 |
| C、相同温度时,CH3COOH的电离平衡常数Ka与NH3?H2O的电离平衡常数Kb相等,所以NH4HCO3的水溶液显碱性 |
| D、升高温度,以上常数均增大 |
某有机物的结构简式如图,下列叙述错误的是( )
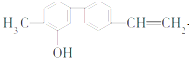

| A、一个分子中含有14个H原子 |
| B、苯环上一氯取代物有2种 |
| C、含有一种含氧官能团 |
| D、分子式是C15H14O |
 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题: 二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应: (不考虑立体结构,其中R为
(不考虑立体结构,其中R为 ).M的一条合成路线如下(部分反应试剂和条件省略).
).M的一条合成路线如下(部分反应试剂和条件省略).
 与
与 的化学性质相似.
的化学性质相似.