题目内容
10.同周期的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性是:H3XO4<H2YO4<HZO4,则下列判断正确的是( )| A. | 非金属性强弱:X>Y>Z | B. | 原子序数大小:X<Y<Z | ||
| C. | 原子半径大小:X<Y<Z | D. | 原子最外层电子数:X>Y>Z |
分析 同周期的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性是:H3XO4<H2YO4<HZO4,则非金属性X<Y<Z,故原子序数X<Y<Z,同周期随原子序数增大原子半径减小,元素非金属性增强,最高化合价越大,原子的最外层电子数越大,据此进行解答.
解答 解:A.同周期的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性是:H3XO4<H2YO4<HZO4,则非金属性X<Y<Z,故A错误;
B.同一周期中,非金属性压强,原子序数越大,则原子序数X<Y<Z,故B正确;
C.同一周期中,原子序数越大,原子半径越小,则原子半径大小:X>Y>Z,故C错误;
D.X、Y、Z的最高化合价分别为+5、+6、+7,则原子的最外层电子数分别为5、6、7,即:X<Y<Z,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g H2O的混合气体.下列说法正确的是( )
| A. | 没有乙烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 有甲烷 | D. | 有乙炔 |
1.下列电子排布式错误的是( )
| A. | 1s22s22p3 | B. | 1s22s22p62d53s1 | C. | [Ar]3d54s1 | D. | [Ar]3d94s1 |
15.如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )
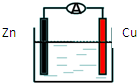

| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+=Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 溶液中硫酸根离子向Cu极移动 |
2.为了加快锌与稀硫酸的反应制氢气的速率,下列方法错误的是( )
| A. | 适当提高硫酸浓度 | B. | 将锌粒变小 | ||
| C. | 将硫酸改为浓硫酸 | D. | 适当升高温度 |
19.高炉炼铁中发生的主要反应为Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,下列有关该反应的说法正确( )
| A. | 该反应属于置换反应 | B. | CO作还原剂 | ||
| C. | Fe2O3发生氧化反应 | D. | CO被还原 |
 ,W的最高正价为+7.
,W的最高正价为+7.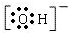 .
.