题目内容
根据盖斯定律计算:已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石,s)+O2(g)═CO2(g)△H1=-395.41kJ/mol,C(石墨,s)+O2(g)═CO2(g)△H2=-393.51kJ/mol,
(1)则金刚石转化为石墨时的热化学方程式为 ,由此看来更稳定的碳的同素异形体为 .
(2)若取金刚石和石墨的混合晶体共1mol在O2中完全燃烧,产生热量为Q kJ,则金刚石和石墨的物 质的量之比为(用含Q的代数式表示) .
(1)则金刚石转化为石墨时的热化学方程式为
(2)若取金刚石和石墨的混合晶体共1mol在O2中完全燃烧,产生热量为Q kJ,则金刚石和石墨的物 质的量之比为(用含Q的代数式表示)
考点:用盖斯定律进行有关反应热的计算,有关反应热的计算
专题:化学反应中的能量变化
分析:(1)根据1mol金刚石和石墨分别在氧气中完全燃烧时放出的热量,利用盖斯定律来分析金刚石转化石墨时的能量变化,能量越低的物质越稳定;
(2)利用十字交叉法来计算金刚石和石墨的物质的量之比.
(2)利用十字交叉法来计算金刚石和石墨的物质的量之比.
解答:
解:(1)由盖斯定律可知,要得到金刚石转化为石墨的热量变化,可将二者在氧气中完全燃烧时放出的热量相减即可,
得C(金刚石)═C(石墨)△H=-395.41kJ/mol-(-393.51kJ/mol)=-1.90kJ/mol,
即金刚石转化为石墨放出热量,说明石墨的能量更低,比金刚石稳定,
故答案为:C(s,金刚石)═C(s,石墨)△H=-1.9 kJ/mol;石墨;
(2)金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,
由十字交叉法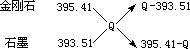 ,
,
可得二者物质的量比为
,
故答案为:
.
得C(金刚石)═C(石墨)△H=-395.41kJ/mol-(-393.51kJ/mol)=-1.90kJ/mol,
即金刚石转化为石墨放出热量,说明石墨的能量更低,比金刚石稳定,
故答案为:C(s,金刚石)═C(s,石墨)△H=-1.9 kJ/mol;石墨;
(2)金刚石和石墨混合晶体共1mol 在O2中完全燃烧,产生热量为QkJ,
由十字交叉法
 ,
,可得二者物质的量比为
| Q-393.51 |
| 395.41-Q |
故答案为:
| Q-393.51 |
| 395.41-Q |
点评:本题考查学生利用盖斯定律来分析金刚石和石墨的转化,明确反应热、热量、能量与物质的稳定性的关系即可解答,对于混合物的燃烧及成分的确定学生应学会利用十字交叉法来快速解答.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
下列离子方程式中,正确的是( )
| A、氯气通入水中,溶液呈酸性:Cl2+H2O?2H++Cl-+ClO- | ||||
B、用铜做电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| C、NaHS电离方程式:NaHS?Na++HS- | ||||
| D、NH4Cl水解反应:NH4++2H2O?NH3?H2O+H3O+ |
下列各组反应中最终肯定有白色沉淀的是( )
| A、向饱和碳酸钠溶液中通入过量CO2 |
| B、氯化亚铁溶液中加入少量过氧化钠 |
| C、AlCl3溶液中加入过量氢氧化钠溶液 |
| D、氯化钙溶液中通入过量CO2 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| B、在含Fe3+的溶液:I-、K+、SCN-、Mg2+ |
| C、与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- |
| D、加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
有铝、铁组成的混合物,分为等质量的两份,分别投入到足量的稀盐酸和足量的稀氢氧化钠溶液中,放出氢气体积比为2:1(同温同压下).则该混合物铝和铁的关系正确的是( )
| A、物质的量之比为1:1 |
| B、物质的量之比为2:3 |
| C、质量之比为56:27 |
| D、条件不足无法计算 |
 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通. 某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:

 Ⅱ.
Ⅱ.