题目内容
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| B、在含Fe3+的溶液:I-、K+、SCN-、Mg2+ |
| C、与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- |
| D、加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
考点:离子共存问题
专题:离子反应专题
分析:离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、双水解反应的就能共存,
A.甲基橙呈红色的溶液呈酸性;
B.含有铁离子的溶液中不能存在和铁离子反应的离子;
C.与铝反应生成大量氢气的溶液呈强碱性或非氧化性酸性;
D.加入NaOH后加热既有气体放出又有沉淀生成的溶液中存在铵根离子、存在生成沉淀的离子.
A.甲基橙呈红色的溶液呈酸性;
B.含有铁离子的溶液中不能存在和铁离子反应的离子;
C.与铝反应生成大量氢气的溶液呈强碱性或非氧化性酸性;
D.加入NaOH后加热既有气体放出又有沉淀生成的溶液中存在铵根离子、存在生成沉淀的离子.
解答:
解:A.甲基橙呈红色的溶液呈酸性,AlO2-不能在酸性条件下大量存在,故A错误;
B.含有铁离子的溶液中不能存在和铁离子反应的离子,铁离子和I-发生氧化还原反应生成亚铁离子和碘,和SCN-反应生成络合物,所以不能大量共存,故B错误;
C.与铝反应生成大量氢气的溶液呈强碱性或非氧化性酸性,酸性条件下硝酸和Al反应生成NO而不是氢气,强碱性条件下铵根离子和氢氧根离子反应生成弱电解质一水合氨,所以不能大量共存,故C错误;
D.加入NaOH后加热既有气体放出又有沉淀生成的溶液中存在铵根离子、存在生成沉淀的离子,Ca2+、HCO3-和氢氧根离子反应生成碳酸钙沉淀,NH4+和氢氧根离子反应生成弱电解质一水合氨,所以存在,故D正确;
故选D.
B.含有铁离子的溶液中不能存在和铁离子反应的离子,铁离子和I-发生氧化还原反应生成亚铁离子和碘,和SCN-反应生成络合物,所以不能大量共存,故B错误;
C.与铝反应生成大量氢气的溶液呈强碱性或非氧化性酸性,酸性条件下硝酸和Al反应生成NO而不是氢气,强碱性条件下铵根离子和氢氧根离子反应生成弱电解质一水合氨,所以不能大量共存,故C错误;
D.加入NaOH后加热既有气体放出又有沉淀生成的溶液中存在铵根离子、存在生成沉淀的离子,Ca2+、HCO3-和氢氧根离子反应生成碳酸钙沉淀,NH4+和氢氧根离子反应生成弱电解质一水合氨,所以存在,故D正确;
故选D.
点评:本题考查离子共存,为高考热点,明确离子共存条件及离子性质是解本题关键,注意硝酸和金属反应不生成氢气,为易错点.

练习册系列答案
相关题目
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )
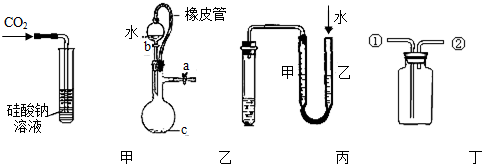

| A、甲装置:可用来证明碳的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法不能检查此装置的气密性 |
| D、丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集一氧化氮 |
下列离子方程式书写正确的是( )
| A、H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
| B、Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C、向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-═CO32-+H2O |
下列有关物质的应用不正确的是( )
| A、碳酸氢钠具有弱碱性,可治疗胃酸过多 |
| B、氧化镁熔点高,可做耐高温材料 |
| C、二氧化硫具有漂白性,可用于漂白纸浆和草帽辫 |
| D、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
将物质的量之比为1:1的Na2CO3与NaHCO3溶于水配成等体积的溶液,则所得溶液中的钠离子的物质的量之比为 ;若将两种溶液分别与同浓度的盐酸完全反应,消耗盐酸的体积比为 ,放出CO2的体积比为 .
向溴化铁溶液中加入足量新制氯水,将溶液蒸干并充分灼烧,最后得到的固体是( )
| A、Fe2O3 |
| B、FeCl3 |
| C、FeCl3和Br2 |
| D、Fe(OH)3 |
 X、Y、Z、W四种常见元素,且均为短周期元素.已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧.
X、Y、Z、W四种常见元素,且均为短周期元素.已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧.