题目内容
6.下列溶液中导电性最强的是( )| A. | 1L 0.1mol/L醋酸 | B. | 0.5L 0.1mol/L H2SO4溶液 | ||
| C. | 1L 0.1mol/L盐酸 | D. | 2L 0.1mol/L H2SO3溶液 |
分析 溶液的导电性取决于溶液离子浓度大小,离子浓度越大,则导电性越强,以此解答.
解答 解:A、醋酸为弱电解质,不能完全离子,溶液中阴阳离子总浓度小于0.2moL/L;
B、0.1mol/LH2SO4溶液中阴阳离子总浓度等于0.3mol/L;
C、0.1mol/L 盐酸中阴阳离子总浓度等于0.2mol/L;
D、0.1mol/LH2SO3溶液不能完全电离,如第一步完全电离,则阴阳离子总浓度略大于0.2mol/L;
则离子浓度最大的为B,导电性应最强,
故选:B.
点评 本题考查电解质溶液的导电性强弱的比较,难度不大,注意把握电解质的强弱以及溶液总离子浓度的大小比较.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
20.在2.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应A(g)?B(g)+C(g)△H=+85.1kJ•mol-1反应时间(t)与容器内气体总压强(p)的数据见表:
下列说法错误的是( )
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| A. | 反应在前四小时的平均速率为v(A)═0.0122mol•L-1•h-1 | |
| B. | 他条件不变,升温,正逆反应速率都增大 | |
| C. | 该反应到达平衡时A的转化率为94.1% | |
| D. | 将容积的体积缩小到原来的一半,达平衡后C的百分含量降低 |
17.能正确表示下列反应的离子方程式的是( )
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 将铁屑加入Fe3+溶液中:Fe3++Fe═2Fe2+ |
14.实验室中,有关试剂的保存方法错误的是( )
| A. | 烧碱溶液保存在带玻璃塞的试剂瓶中 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 浓硝酸保存在棕色细口瓶中 |
1.下列物质的结构或性质与氢键无关的是( )
| A. | 乙醚的沸点 | B. | 乙醇在水中的溶解度 | ||
| C. | 对羟基苯甲醛的沸点 | D. | DNA的双螺旋结构 |
18.今有高聚物
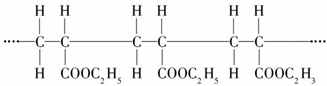
下列对此高聚物的分析中,正确的是( )

下列对此高聚物的分析中,正确的是( )
| A. | 其单体是CH2=CH2和HCOOC2H5 | B. | 这是缩聚反应产物 | ||
| C. | 其链节是CH3CH2-COOC2H5 | D. | 其单体是CH2=CH-COOC2H5 |
15.一定温度时,测得纯水中c(OH-)=2.5×10-7 mol•L-1,则c(H+)为( )
| A. | 2.5×10-7 mol•L-1 | B. | 1.0×10-7 mol•L-1 | ||
| C. | $\frac{1×1{0}^{-14}}{2.5×1{0}^{-7}}$mol•L-1 | D. | 无法确定c(H+) |
16.下列各组物质中,不满足组内任意两种物质在一定条件下(可以配成水溶液)均能发生反应的是( )
| A. | Al203、HCl、NaOH | B. | NH3、O2、HNO3 | ||
| C. | SiO2、NaOH、HF | D. | CO2、Ca(OH)2、Na2CO3 |