题目内容
11.下列物质中:①Fe②熔融氢氧化钠③CO2④乙醇⑤BaSO4⑥盐酸⑦NaHSO4固体其中:(1)属于电解质的是②⑤⑦
(2)属于非电解质的是③④
(3)能导电的是①②⑥.
(4)NaHSO4在水溶液中的电离方程式是NaHSO4=Na++H++SO42-.
分析 物质导电的原因:含有自由移动的离子或自由电子;
电解质是指在水溶液里或熔融状态下能导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
硫酸氢钠为强电解质,在水溶液中完全电离出钠离子、氢离子和硫酸根离子.
解答 解:①Fe含有自由电子,能够导电;是单质既不是电解质也不是非电解质;
②熔融氢氧化钠含有自由移动的离子,能够导电;熔融状态下能导电的化合物是电解质;
③CO2不含有自由移动的离子或自由电子,不导电;本身不能电离,属于非电解质;
④乙醇不含有自由移动的离子或自由电子,不导电;在水溶液里和熔融状态下都不能导电的化合物,是非电解质;
⑤BaSO4不含有自由移动的离子或自由电子,不导电;熔融状态下能导电的化合物,是电解质;
⑥盐酸含有自由移动的离子,能够导电;是混合物既不是电解质也不是非电解质;
⑦NaHSO4固体不含有自由移动的离子或自由电子,不导电;在水溶液里或熔融状态下能导电的化合物,是电解质;
所以:(1)属于电解质的是②⑤⑦;
(2)属于非电解质的是③④;
(3)能导电的是①②⑥;
故答案为:(1)②⑤⑦;
(2)③④;
(3)①②⑥;
(4)硫酸氢钠为强电解质,在水溶液中完全电离出钠离子、氢离子和硫酸根离子,电离方程式:NaHSO4=Na++H++SO42-;
故答案为:NaHSO4=Na++H++SO42-.
点评 本题考查了电解质溶液导电的原因及电解质、非电解质判断,明确电解质、非电解质概念是解题关键,注意单质与混合物既不是电解质也不是非电解质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列说法中正确的是( )
| A. | 2CO2(g)═2CO(g)+O2(g)△H=+566.0 kJ•mol-1,则 CO(g)的燃烧热是-283.0kJ•mol-1 | |
| B. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1,则1molH2SO4和1molBa(OH)2反应的反应热△H=-114.6kJ•mol-1 | |
| C. | 石墨转化为金刚石是吸热反应,可知金刚石的燃烧热更大 | |
| D. | 在恒温时,压缩容器的体积,则2SO2+O2?2SO3平衡正向移动,该反应的△H减小 |
19.等物质的量的下列化合物与足量浓盐酸反应,得到氯气物质的量最多的是( )
已知:MnO4-+H++Cl--→Mn2++Cl2↑+H2O(未配平)
ClO3-+H++Cl--→Cl2↑+H2O(未配平)
ClO-+H++Cl--→Cl2↑+H2O(未配平)
已知:MnO4-+H++Cl--→Mn2++Cl2↑+H2O(未配平)
ClO3-+H++Cl--→Cl2↑+H2O(未配平)
ClO-+H++Cl--→Cl2↑+H2O(未配平)
| A. | KClO3 | B. | KMnO4 | C. | MnO2 | D. | Ca(ClO)2 |
6.下列溶液中导电性最强的是( )
| A. | 1L 0.1mol/L醋酸 | B. | 0.5L 0.1mol/L H2SO4溶液 | ||
| C. | 1L 0.1mol/L盐酸 | D. | 2L 0.1mol/L H2SO3溶液 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 将100mL 0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.0l NA | |
| B. | Na2O2与足量的水反应生成1 molO2,转移电子数目为2 NA | |
| C. | 某密闭容器中有2mo1SO2和1mol O2,在一定条件下充分反应,转移的电子数为4 NA | |
| D. | 18g重水(D2O)所含的电子数为1 NA |
20.用下列实验装置完成对应实验,能达到实验目的是( )
| A. | 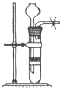 用大理石和盐酸制取CO2 | B. | 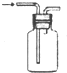 用排气法收集氨气 | ||
| C. | 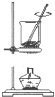 将干海带灼烧成灰 | D. | 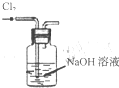 除去Cl2中的HCl |
1.两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的( )
| A. | 电子总数 | B. | 原子总数 | C. | 质量 | D. | 质子总数 |