题目内容
5.科学家制造出由4个氧原子构成的氧分子,并用质谱仪探测后证实了它的存在.下列关于该氧分子的说法正确的是( )| A. | 是氧元素的一种同位素 | |
| B. | 是氧元素的一种单质,分子内含有共价键 | |
| C. | 是一种新的氧化物 | |
| D. | 是臭氧的同分异构体 |
分析 A.质子数相同中子数不同的同一元素互称同位素,同位素是原子,据此分析解答;
B.同一元素组成的纯净物是单质;
C.氧化物是指只含有两种元素,且其中一种元素是氧元素的化合物;
D.同分异构体是分子式相同结构式不同的化合物,据此分析解答.
解答 解:A.4个氧原子构成的氧分子即O4是同一元素组成的物质,所以是单质,不属于同位素,故A错误.
B.同一元素组成的纯净物是单质,非金属原子间形成共价键,则O4是氧元素的一种单质,分子内含有共价键,故B正确;
C.4个氧原子构成的氧分子即O4是同一元素组成的物质,所以是单质,不属于氧化物,故C错误;
D.O4和O3都是由氧元素形成的单质,不属于同分异构体,属于同素异形体,故D错误;
故选:B.
点评 本题的重点考查了同位素、同素异形体、同分异构体概念和区别,注意把握几个概念的研究对象,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
相关题目
15.已知2-丁烯有顺、反两种同分异构体,在某条件下两种气体处于平衡,下列说法正确的是( )
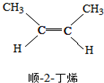 ?
? △H=-4.2kJ/mol.
△H=-4.2kJ/mol.
 ?
? △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热比反-2-丁烯大 | |
| C. | 降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 |
16.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2中氧的化合价为-2 |
20.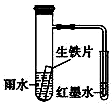 如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
 如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )| A. | 生铁片中的碳是原电池的阳极,发生还原反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 墨水液面回升时,碳电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
10.下列化学反应的离子方程式其中正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ | |
| D. | 氢氧化钡溶液与硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
17.常温下,下列溶液可以用铝制容器盛装的是( )
| A. | 浓盐酸 | B. | 稀硝酸 | C. | 浓硝酸 | D. | 氢氧化钠溶液 |
14.下列反应属于化合反应的是( )
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | ||
| C. | 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑ | D. | NaOH+Al(OH)3═NaAlO2+2H2O |
15.下列说法正确的是( )
| A. | 可逆反应的化学平衡常数K值的大小和反应的温度、各组分的浓度以及体系的压强都有关 | |
| B. | 任何条件下,只要c(H+)>c(OH-),水溶液就一定显酸性 | |
| C. | 盐酸中无OH-,烧碱溶液中无H+ | |
| D. | 水的离子积常数Kw和水的电离平衡常数K电离是两个没有任何关系的物理量 |
 ,名称是3-甲基-1-丁炔;
,名称是3-甲基-1-丁炔; ;
;