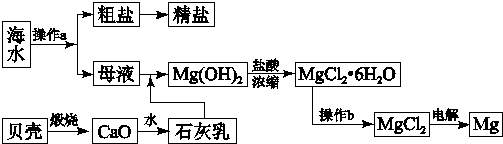
题目内容
11.常温下,下列四种溶液:①pH=0的盐酸,②0.01mol•L-1的NaOH溶液,③pH=11的Na2CO3溶液中,由水电离生成的H+的物质的量浓度之比为( )| A. | 1:100:1011 | B. | 1:12:11 | C. | 14:12:11 | D. | 14:2:1 |
分析 电离平衡为H2O?H++OH-,在水中加入酸或者碱溶液,导致溶液中氢离子或者氢氧根离子浓度增大,抑制了水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,结合Kw=c(H+)×c(OH-)计算该题.
解答 解:酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的,
①pH=0的盐酸,溶液中氢离子浓度为1mol/L,水电离的氢氧根离子为 $\frac{1×1{0}^{-14}}{1}$mol/L=1×10-14mol/L;
②0.01mol/L的NaOH 溶液,溶液中氢离子浓度为 $\frac{1×1{0}^{-14}}{0.01}$mol/L=1×10-12mol/L;
④pH=11的Na2CO3 溶液,溶液中氢氧跟离子浓度为1×10-3mol/L,是由水电离的;
所以由水电离产生的c(H+)之比①:②:③=1×10-14mol/L:1×10-12mol/L:1×10-3mol/L=1:10:1011,
故选A.
点评 本题考查了水的电离以及pH的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,解题关键是合理判断酸碱溶液中水电离情况分析及计算方法,注意酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
2.在一密闭容器中进行如下反应:A(g)+B(g)?2C(g)+2D,此反应符合图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是( )

| A. | 正反应为吸热反应,D是固体 | B. | 正反应为吸热反应,D是气体 | ||
| C. | 正反应为放热反应,D是固体或液体 | D. | 正反应为放热反应,D是气体 |
19.下列叙述正确的是( )
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 阳离子一定有氧化性,可能有还原性 | |
| C. | FeCl3溶液和Fe(OH)3胶体的共性是都能产生丁达尔效应 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
16.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2中氧的化合价为-2 |
20.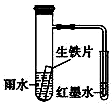 如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
 如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )| A. | 生铁片中的碳是原电池的阳极,发生还原反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 墨水液面回升时,碳电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
1.暴露于空气中不易变质的物质是( )
| A. | 小苏打 | B. | 漂粉精 | C. | Na2O2 | D. | FeSO4溶液 |
 某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.