题目内容
8.某化工厂以天然气、水、空气为基本原料联合生产氨、硝酸,获得了良好的经济效益,下面是其生产流程图.
(1)试剂a可能是NaOH溶液(Na2CO3溶液、氨水也可),设备B的名称为吸收塔,设备A中的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)该化工厂合成氨时的压强40MPa,温度为500℃左右,在此条件下,测定达到平衡时混合气体中NH3的体积分数约为35.2%.
①在保持温度、压强不变的情况下,写出一种能提高合成塔中H2转化率的方法及时分离出NH3或者增大N2的浓度,温度越低,NH3的产率越高,为何不在较低温度下进行合成若温度过低,反应速率太慢,会导致单位时间内生成的NH3量很少.
②从合成塔中出来的NH3的体积分数通常约为15%,其原因是合成塔中反应并没有达到平衡.
(3)从设备B中出来的硝酸浓度较小,通常先加入一定量的硝酸镁后再进行蒸馏
①下列可以代替硝酸镁加入到蒸馏塔中的是:ab
a.浓硫酸b.硫酸镁c.生石灰
②蒸馏时通常采用减压蒸馏,这样做的主要目的是可使HNO3在较低温度下气化,避免硝酸分解.
(4)用尿素[CO(NH2)2]处理尾气时可得到纯净的两种常见无毒气体,反应过程为:NO、NO2在水中反应转化亚硝酸,然后亚硝酸再与尿素反应,写出后者反应的化学方程式:2HNO2+CO(NH2)2=CO2↑+2N2↑+3H2O.
分析 (1)吸收二氧化碳可用碱液吸收;设备B是吸收塔;设备A中发生氨的催化氧化反应;
(2)①从平衡正向移动来分析增大氢气的转化率;温度太低,速率会很慢;
②达到平衡时混合气体中NH3的体积分数约为35.2%,从合成塔中出来的NH3的体积分数通常约为15%,说明未达到平衡;
(3)①加的物质不能与硝酸反应,沸点要高,能吸水;
②硝酸不稳定,温度高要分解;
(4)亚硝酸再与尿素反应可得到纯净的两种常见无毒气体,从元素种类可知产物是二氧化碳、氮气.
解答 解:(1)吸收二氧化碳可用碱液吸收,可用NaOH溶液(Na2CO3溶液、氨水也可);设备B是吸收塔;设备A中发生氨的催化氧化,方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:NaOH溶液(Na2CO3溶液、氨水也可);吸收塔;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)①从平衡正向移动来分析增大氢气的转化率,及时分离出NH3或者增大N2的浓度,平衡正向移动,氢气的转化率得到提高;若温度过低,反应速率太慢,会导致单位时间内生成的NH3量很少,
故答案为:及时分离出NH3或者增大N2的浓度;若温度过低,反应速率太慢,会导致单位时间内生成的NH3量很少;
②达到平衡时混合气体中NH3的体积分数约为35.2%,从合成塔中出来的NH3的体积分数通常约为15%,说明未达到平衡,
故答案为:合成塔中反应并没有达到平衡;
(3)①加的物质不能与硝酸反应,沸点要高,能吸水,只有a、b符合,c要与硝酸反应,
故答案为:a、b;
②硝酸不稳定,温度高要分解,蒸馏时通常采用减压蒸馏可使HNO3在较低温度下气化,避免硝酸分解,
故答案为:可使HNO3在较低温度下气化,避免硝酸分解;
(4)亚硝酸再与尿素反应可得到纯净的两种常见无毒气体,从元素种类可知产物是二氧化碳、氮气,方程式为:2HNO2+CO(NH2)2=CO2↑+2N2↑+3H2O,
故答案为:2HNO2+CO(NH2)2=CO2↑+2N2↑+3H2O.
点评 本题以天然气、水、空气为基本原料联合生产氨、硝酸,考查了物质的性质,化学反应速率、化学平衡、环境保护等在生产中的应用,题目难度适中.

 全优点练单元计划系列答案
全优点练单元计划系列答案①加成反应②氧化反应③加氢反应④消去反应⑤取代反应⑥水解反应⑦酯化反应⑧加聚反应.
| A. | ①③④⑤ | B. | ③⑦⑧ | C. | ④⑥⑧ | D. | ①④⑥ |
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. |  1,3,4-三甲苯 1,3,4-三甲苯 | ||
| C. | CH3CH2CH(OH)CH3 2-丁醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
| A. | CH3CH=CHBr | B. | CH3-Cl | C. | CH3CH=CH2 | D. | CH3CH=C(CH3)2 |
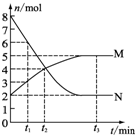 一定温度下,在容积为V L的密闭容器中进行aN(g)?bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行aN(g)?bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
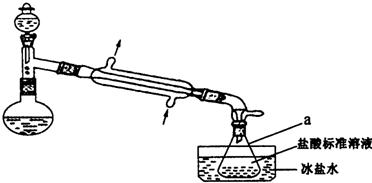 某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验:
某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验: