题目内容
将9.08g FeO、Cu(NO3)2混合物全部溶于150mL 1.0mol/L的稀硫酸中,放出无色气体,无色气遇到空气后变成红棕色,再向溶液中加入足量铁粉,充分反应后产生224mL标准状况下的H2.
(1)写出混合物溶于稀硫酸的离子方程式;
(2)求混合物中FeO和Cu(NO3)2的物质的量.
(1)写出混合物溶于稀硫酸的离子方程式;
(2)求混合物中FeO和Cu(NO3)2的物质的量.
考点:化学方程式的有关计算
专题:计算题
分析:将9.08g FeO、Cu(NO3)2混合物全部溶于150mL 1.0mol/L的稀硫酸中,氧化亚铁和硫酸反应方程式为:FeO+H2SO4=FeSO4+H2O,硫酸亚铁在酸性条件下被硝酸根离子氧化成铁离子,无色气体为NO,反应离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,一氧化氮和氧气反应生成红棕色二氧化氮,过量硫酸与铁反应:Fe+2H+=Fe2++H2↑,放出氢气,说明硝酸根离子完全反应,根据氢气的体积可计算剩余硫酸的物质的量,根据硫酸和氧化亚铁、硝酸铜反应列式计算.
解答:
解:(1)FeO和硫酸发生复分解反应,离子方程式为:FeO+2H+=Fe2++H2O;亚铁离子具有还原性,可被硝酸根离子氧化,
离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,
答:反应离子方程式为:FeO+2H+=Fe2++H2O;3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(2)氢气的物质的量为:
=0.01mol,故与铁反应的硫酸为0.01mol,与FeO、Cu(NO3)2反应的硫酸为:
0.15L×1.0mol/L=0.15mol-0.01mol,
设氧化亚铁的物质的量为x,硝酸铜的物质的量为y,
根据反应:FeO+H2SO4=FeSO4+H2O,3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O可列出方程式:
x x x
x
解得:x=0.084mol,y=0.016mol;
答:混合物中FeO和Cu(NO3)2的物质的量分别为:0.084mol,0.016mol.
离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,
答:反应离子方程式为:FeO+2H+=Fe2++H2O;3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(2)氢气的物质的量为:
| 0.224L |
| 22.4L/mol |
0.15L×1.0mol/L=0.15mol-0.01mol,
设氧化亚铁的物质的量为x,硝酸铜的物质的量为y,
根据反应:FeO+H2SO4=FeSO4+H2O,3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O可列出方程式:
x x x
| 4 |
| 3 |
|
答:混合物中FeO和Cu(NO3)2的物质的量分别为:0.084mol,0.016mol.
点评:本题考查了反应方程式的计算,中等难度,搞清反应原理是解题的关键.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
设NA代表阿伏加德罗常数,下列说法不正确的是( )
| A、14 g氮气所含原子数为NA |
| B、1 mol 水中所含电子数为10NA |
| C、32gO2与32gO3所含原子数分别为2NA和3NA |
| D、0.5 molNa2CO3与1.5mol H2O所含氧原子数目均为1.5NA |
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,有白色沉淀产生,再加入足量稀HNO3,充分振荡后,仍有白色沉淀.对此下述结论正确的是( )
| A、Na2SO3已部分氧化 |
| B、加入Ba(NO3)2溶液所生成的沉淀一定含有BaSO4 |
| C、加入HNO3后的沉淀一定是BaSO4 |
| D、此实验不能确定Na2SO3是否被氧化 |
甲烷燃烧的化学方程式为CH4+2O2=CO2+2H2O.常温常压下,将1体积甲烷在3体积氧气中完全燃烧,再将生成的气体恢复到原来的温度和压强.求生成多少体积的二氧化碳?剩余什么气体?它的体积是多少??
下表所列各组物质中,物质之间按箭头方向通过一步反应不能实现如图所示转化的是( )
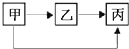

| 物质 选项 | 甲 | 乙 | 丙 |
| A | CuO | CO2 | H2O |
| B | C | CO | CO2 |
| C | CaCO3 | CaO | Ca(OH)2 |
| D | H2SO4 | H2O | H2 |
| A、A | B、B | C、C | D、D |
