题目内容
实验室制备、收集干燥的SO2,所需仪器如下.

(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ → → → →f.
(2)装置A中发生反应的化学方程式为
(3)验证产生的气体是SO2的方法是 .

(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→
(2)装置A中发生反应的化学方程式为
(3)验证产生的气体是SO2的方法是
考点:气体发生装置,气体的收集,尾气处理装置
专题:实验题
分析:(1)利用实验仪器的连接,铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;安全瓶的使用以及尾气吸收来分析;
(2)铜和浓硫酸在加热的条件下产生硫酸铜、二氧化硫和水;
(3)二氧化硫的验证,利用其特殊性质漂白性来分析.
(2)铜和浓硫酸在加热的条件下产生硫酸铜、二氧化硫和水;
(3)二氧化硫的验证,利用其特殊性质漂白性来分析.
解答:
解:(1)收集二氧化硫应先干燥再收集,故先通过d、e,二氧化硫的密度比空气大,要从c口进气,b口出来进行尾气处理.因为二氧化硫易于氢氧化钠反应,故f的作用是安全瓶,防止倒吸;盛放NaOH溶液的烧杯为尾气处理装置要放置在最后;
故答案为:d;e;c;b;
(2)铜和浓硫酸在加热的条件下产生硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(3)检验二氧化硫的一般方法是将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫,
故答案为:将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.
故答案为:d;e;c;b;
(2)铜和浓硫酸在加热的条件下产生硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(3)检验二氧化硫的一般方法是将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫,
故答案为:将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.
点评:本题考查了气体的实验室制法,要熟练掌握反应原理、发生装置的选择、收集装置的选择.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、根据△H可以判断此反应是放热反应还是吸热反应 |
| B、根据化学反应速率可以判断反应物转变为生成物的难易 |
| C、根据熵变还不可以判断化学反应能否自发进行 |
| D、根据化学平衡常数可以判断化学反应进行的限度 |
在恒温恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1,下列选项中能表示该反应达到平衡状态的是 ( )(填字母序号).
| A、混合气体的压强不再发生变化 |
| B、混合气体的密度不再发生变化 |
| C、反应容器中N2、NH3的物质的量的比值不再发生变化 |
| D、单位时间内断开a个H-H键的同时形成3a个N-H键 |
| E、三种物质的浓度之比恰好等于化学方程式中各物质的化学计量数之比 |

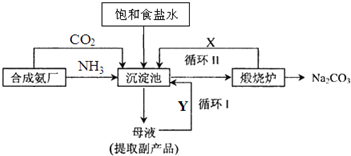

 已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.恒温条件下,容积为1L的恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图所示.
已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.恒温条件下,容积为1L的恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图所示.