题目内容
下列说法不正确的是( )
| A、根据△H可以判断此反应是放热反应还是吸热反应 |
| B、根据化学反应速率可以判断反应物转变为生成物的难易 |
| C、根据熵变还不可以判断化学反应能否自发进行 |
| D、根据化学平衡常数可以判断化学反应进行的限度 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、△H<0,为放热反应,△H>0,为吸热反应;
B、化学反应速率是表示化学反应进行快慢程度的物理量;
C、△G=△H-T△S<0,反应自发进行,△G=△H-T△S>0,反应不能自发进行;
D、化学平衡常数=
,化学平衡常数越大说明平衡体系中生成物所占的比例越大,反应进行的程度越大.
B、化学反应速率是表示化学反应进行快慢程度的物理量;
C、△G=△H-T△S<0,反应自发进行,△G=△H-T△S>0,反应不能自发进行;
D、化学平衡常数=
| 生成物浓度幂之积 |
| 反应物浓度幂之积 |
解答:
解;A、△H<0,为放热反应,△H>0,为吸热反应,△H可以判断此反应是放热反应还是吸热反应,故A正确;
B、化学反应速率是表示化学反应进行快慢程度的物理量,不能表示反应的难易程度,故B错误;
C、△G=△H-T△S<0,反应自发进行,△G=△H-T△S>0,反应不能自发进行,不能单独通过熵变判断反应能否自发进行,故C正确;
D、化学平衡常数=
,化学平衡常数越大说明平衡体系中生成物所占的比例越大,反应进行的程度越大,故D正确.
故选:B.
B、化学反应速率是表示化学反应进行快慢程度的物理量,不能表示反应的难易程度,故B错误;
C、△G=△H-T△S<0,反应自发进行,△G=△H-T△S>0,反应不能自发进行,不能单独通过熵变判断反应能否自发进行,故C正确;
D、化学平衡常数=
| 生成物浓度幂之积 |
| 反应物浓度幂之积 |
故选:B.
点评:本题考查了反应热、化学反应速率、吉布斯自由能、化学平衡常数等概念,难度不大,注意知识的积累.

练习册系列答案
相关题目
煤化工生产中常研究不同温度下平衡常数、投料比及产率等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:则下列说法错误的是( )
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A、在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50% |
| B、在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小 |
| C、恒温、恒容条件下,若混合气体的平均相对分子质量一定,不能确定可逆反应是否达到平衡 |
| D、上述正向反应是放热反应 |
下列有机反应类型判断错误的是( )
| A、CH4+Cl2→CH3Cl+HCl 取代反应 | ||
B、CH2=CH2+HCl
| ||
C、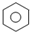 +Br2 +Br2
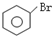 +HBr 取代反应 +HBr 取代反应 | ||
D、2CH3CH2OH+O2
|
下列关于氯气的说法正确的是( )
| A、难溶于水 | B、无色无味 |
| C、具有漂白性 | D、有毒的气体 |






