题目内容
8.X、Y两种短周期主族元素能形成XY2型化合物,已知XY2中共有22个电子,若XY2为共价化合物,其电子式为 .
.
分析 X、Y两种短周期主族元素能形成XY2型化合物,已知XY2中共有22个电子,则X、Y为非金属元素,X为碳、Y为氧,XY2为CO2,二氧化碳中碳原子与两个氧原子各共用2对电子,据此解答.
解答 解:X、Y两种短周期主族元素能形成XY2型化合物,共有22个电子,则X、Y为非金属元素,X为碳、Y为氧,二氧化碳中碳原子与两个氧原子各共用2对电子,电子式为 ,
,
故答案为: .
.
点评 本题考查了电子式的书写,准确推断XY2物质及明确物质所含有化学键类型是解题关键,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
19.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O下列结论不正确的是( )
| A. | 放电时PbO2为正极,反应的离子方程式为:PbO2+4H++2e-+SO42-═PbSO4+2H2O | |
| B. | 充电时Pb电极为阴极,反应的离子方程式为:PbSO4+2e-═Pb+SO42- | |
| C. | 放电时电解质溶液密度不断减小,可根据电解液密度来判断是否需要充电 | |
| D. | 充电时可直接使用交流电源,不需要充电器也可充入 |
16.构造原理揭示的电子排布能级顺序,实质是各能级能量高低.若以E(nl)表示某能级的能量,以下各式中正确的是( )
| A. | E(5s)>E(4f)>E(4s)>E(3d) | B. | E(4f)>E(3d)>E(4s)>E(3p) | C. | E(5d)>E(4d)>E(3d)>E(2d) | D. | E(5s)>E(4s)>E(4f)>E(3d) |
3.下列离子方程式书写正确的是( )
| A. | 硫酸铜与氢氧化钡反应:Ba2++SO42-═BaSO4↓ | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | AlCl3溶液中滴加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 金属钠与水反应:2Na+2 H2O═2Na++2OH-+H2↑ |
18.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色.实验流程如下:
请回答:
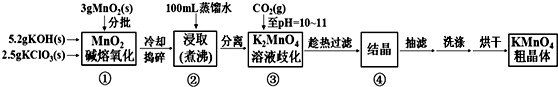
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极.请写出阳极的电极反应式MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
②滴定过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知:常温下0.01mol/L的H2C2O4溶液的pH为2.1).
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
请回答:

(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极.请写出阳极的电极反应式MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
②滴定过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知:常温下0.01mol/L的H2C2O4溶液的pH为2.1).
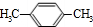 ,BCH2=CH2.
,BCH2=CH2.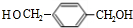 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$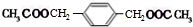 +2H2O.
+2H2O.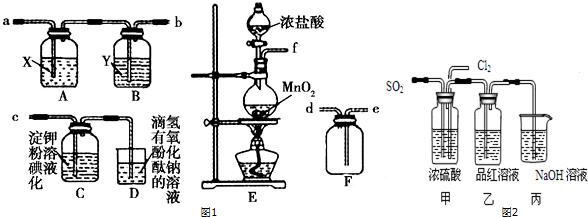
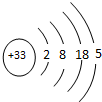 ,
, (1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.
(1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.