题目内容
13.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图1所示的实验装置: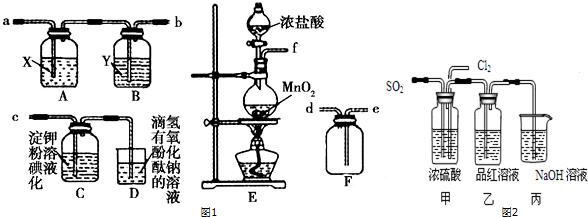
请回答下列问题:
(1)整套实验装置的连接顺序是f接a、b接e、d接c(填各接口处的字母代号).
(2)E装置中制取氯气反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(3)A装置中试剂X是饱和食盐水.
(4)C装置中可观察到的现象是溶液变蓝色,D装置中可观察到的现象是溶液红色逐渐褪去.
(5)某同学认为SO2和Cl2都具有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如图2实验装置:
①实验开始后,乙装置中出现的现象:品红未褪色
②用离子方程式表示乙中产生该现象的原因:SO2+Cl2+2H2O=4H++SO42-+2Cl-.
分析 (1)依据实验目的可知装置连接顺序为:发生装置、净化装置、收集装置、性质检验装置、尾气吸收装置排序;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气、水;
(3)浓盐酸具有挥发性,加热能够促进浓盐酸的挥发,所以制取的氯气中含有氯化氢和水蒸气,依据二者性质选择除杂试剂;
(4)氯气具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,溶液碱性变弱;
(5)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生:SO2+Cl2+2H2O=4H++SO42-+2Cl-,不再具有漂白性.
解答 解:为制取、收集纯净干燥的氯气,并探究氯气的性质,则装置连接为:发生装置、净化装置、收集装置、性质检验装置、尾气吸收装置,A、B为净化装置,C为性质检验装置,D为尾气吸收装置,E为发生装置,F为收集装置,所以正确的顺序为:fabedc;
故答案为:a、b;e、d;c;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气、水,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)浓盐酸具有挥发性,加热能够促进浓盐酸的挥发,要制取纯净干燥的氯气应依次除去氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以选择饱和食盐水除去氯气,然后通过浓硫酸吸收氯气中的水;
故答案为:饱和食盐水;
(4)氯气具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝,所以会看到C中溶液变蓝色;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,溶液碱性变弱,所以溶液红色逐渐褪去;
故答案为:溶液变蓝色; 溶液红色逐渐褪去;
(5)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生:SO2+Cl2+2H2O=4H++SO42-+2Cl-,不再具有漂白性,
故答案为:①品红未褪色; ②SO2+Cl2+2H2O=4H++SO42-+2Cl-.
点评 本题考查了气体的制备和性质检验,熟悉氯气的实验室制备方法及氯气、二氧化硫的性质是解题关键,题目难度中等,侧重考查学生分析、实验能力.

 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | H2O2 | B. | CO2 | C. | SF6 | D. | BeCl2 |
| A. | ②①③④ | B. | ①③④② | C. | ④③①② | D. | ③④②① |

| A. | 分子中所有的碳原子均可能在同一平面内 | |
| B. | 绿原酸可以与FeCl3溶液发生显色反应 | |
| C. | 1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 | |
| D. | 绿原酸不能发生消去反应 |
 .
. .
.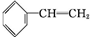 +Br2
+Br2
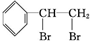 ,
, .
.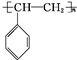 .
.