题目内容
20.表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题: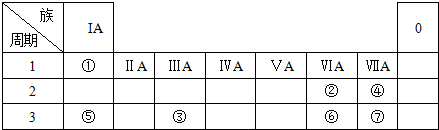
(1)④、⑤、⑦的原子半径由大到小的顺序为Na>Cl>F.
(2)⑥和⑦的最高价含氧酸的酸性强弱为HClO4>H2SO4.
(3)①、②两种元素的原子按1:1组成的常见液态化合物在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)由表中元素形成的物质可发生图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.
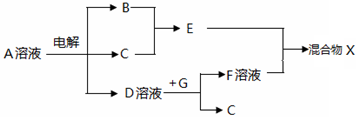
①写出D溶液与G反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出检验A溶液中溶质的阴离子的方法:取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成.
③若图中过量E与F溶液充分反应,混合物X中含有的物质有AlCl3、HCl、H2O、NaCl.
(5)砷(As)的化合物可用于杀虫及医疗.
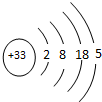
①As的原子结构示意图为
 ,
,②其氢化物的化学式为AsH3.
③Y由②⑤⑦三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为5NaClO+2As+3H2O=2H3AsO4+5NaCl,当消耗1mol还原剂时,电子转移了5mol.
分析 根据元素在周期表中的位置,可知①为H、②为O、③为Al、④为F、⑤为Na、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)同周期自左而右元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故A为NaCl,D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到得到氢气与F,故G为Al,F为NaAlO2;
(5)①As原子核外电子数为33,结合核外电子排布规律书写原子结构示意图;
②As元素最低负化合价为-3,进而书写氢化物化学式;
③Y由②⑤⑦三种元素组成,它的水溶液是生活中常见的消毒剂,则Y为NaClO,As可与NaClO的水溶液反应,产物有As的最高价含氧酸,即生成H3AsO4,氯元素被还原生成NaCl.
解答 解:根据元素在周期表中的位置,可知①为H、②为O、③为Al、④为F、⑤为Na、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Cl>F,
故答案为:Na>Cl>F;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,
故答案为:HClO4;H2SO4;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水,反应离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故A为NaCl,D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到得到氢气与F,故G为Al,F为NaAlO2,则:
①D溶液与G反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②检验NaCl溶液中溶质的阴离子的方法:取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成,
故答案为:取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成;
③若图中过量HCl与NaAlO2溶液充分反应,混合物X中含有的物质有:AlCl3、HCl、H2O、NaCl,
故答案为:AlCl3、HCl、H2O、NaCl;
(5)①As原子核外电子数为33,原子结构示意图为: ,
,
故答案为: ;
;
②As元素最低负化合价为-3,氢化物化学式为AsH3,
故答案为:AsH3;
③Y由②⑤⑦三种元素组成,它的水溶液是生活中常见的消毒剂,则Y为NaClO,As可与NaClO的水溶液反应,产物有As的最高价含氧酸,即生成H3AsO4,氯元素被还原生成NaCl,该反应的化学方程式为:5NaClO+2As+3H2O=2H3AsO4+5NaCl,还原剂为As,当消耗1mol还原剂时,转移电子为5mol,
故答案为:5NaClO+2As+3H2O=2H3AsO4+5NaCl;5.
点评 本题考查元素周期表与元素周期律、无机物的推断,难度中等,(4)中关键是根据离子放电顺序理解电解原理判断A物质,注意混合物X与E、F的量有关,需要学生具备扎实的基础.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案| A. | n+8 | B. | n+16 | C. | n+18 | D. | n+32 |
| A. | 原混合溶液中c(K+)为2 mol•L-1 | |
| B. | 上述电解过程中共转移2 mol电子 | |
| C. | 向电解后得到的体系中加1molCu2(OH)2CO3固体,可使溶液恢复至电解前的浓度 | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
| A. | n-2m | B. | 2m-n | C. | 8+n-2m | D. | 2m-n-8 |
| A. | 溶液中的c(OH-)为1×10-10mol/L | |
| B. | 溶液中的c(H+)为1×10-4mol/L | |
| C. | 溶液中由水电离出来的c(OH-)为1×10-10mol/L | |
| D. | 溶液中由水电离出来的H+的浓度为1×10-4mol/L |
| A. | 陶瓷的主要成分属于硅酸盐,硅酸盐与酸、碱都不反应 | |
| B. | 青铜铸造的器皿在空气中易发生析氢腐蚀,铜为原电池负极反应物 | |
| C. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,纤维素与淀粉互为同分异构体 | |
| D. | 黑火药反应:2KNO3+S+3C═K2S+N2+3CO2 的还原剂只有C |
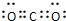 .
. +Br2
+Br2
 ,
, .
. .
.