题目内容
1.氰化钠(NaCN)是一种重要的化工原料,在工业上有许多用途.NaCN有剧毒,含氰废水的工业处理流程如图所示.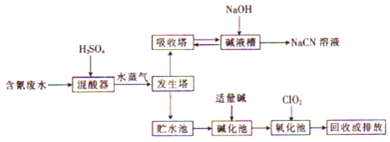
已知:Ka(HCN)<Ka(CH3COOH),[Ag(CN)2]-(aq)?Ag+(aq)+2CN-(aq).
(1)氰化钠遇水会产生剧毒氢氰酸,写出该反应的离子方程式:CN-+H2O?HCN+OH-.
当物质的量浓度相同时,CH3COOH中水电离出的c(H+)小于(填“大于”、“小于”或“等于”)HCN中水电离出的c(H+).
(2)向发生塔中通入水蒸气的目的是促使HCN挥发进入吸收塔.
(3)氧化池中,C1O2可将CN-氧化.且产生两种无毒气体,当反应过程中转移了 6.02×1023个电子时,生成标准状况下气体的总体积是11.2L.
(4)氧化池中,也可用H2O2代替C1O2,反应后生成一种能使红色石蕊试纸变蓝的气体和一种常见的酸式盐,写出该反应的离子方程式:CN-+H2O2+H2O=HCO3-+NH3↑.
(5)电镀厂电镀银时需要降低镀层金属的沉积速率,使镀层更加致密.若电解液使用Na[Ag(CN)2]溶液,则阴极反应式为[[Ag(CN)2]-+e-=Ag+2CN-;解释工业电镀中使用氰离子(CN-)的原因:Ag+和CN-可以结合生成稳定的[Ag(CN)2]-,以控制银离子浓度,使镀层致密.
分析 含氰废水加入稀硫酸在混酸器中反应得到氰酸,通过水蒸气在发生塔中促使HCN挥发进入吸收塔,被氢氧化钠溶液吸收得到NaCN溶液,发生塔中剩余废水先经碱化后再进行氧化,CN-被氯气氧化成低毒的CNO-,CNO-被氯气氧化成无毒的两种气体氮气和二氧化碳,然后加入酸进行中和过滤的碱溶于,处理水回用或排放,
解答 解:(1)氰化钠易发生水解产生氰化氢,方程式为CN-+H2O?HCN+OH-,Ka(HCN)<Ka(CH3COOH),则醋酸酸性较强,等浓度时溶液中氢离子较大,氢离子浓度越大,越易抑制水的电离,则CH3COOH中水电离出的c(H+) 小于HCN中水电离出的c(H+).
故答案为:CN-+H2O?HCN+OH-;小于;
(2)向发生塔中通水蒸汽的目的是促使HCN挥发进入吸收塔,故答案为:促使HCN挥发进入吸收塔;
(3)CNO-被氯气氧化成无毒的两种气体是氮气和二氧化碳,发生2CNO-+3Cl2+4OH-=N2↑+2CO2↑+6Cl-+2H2O,反应中氯气为氧化剂,C元素化合价不变,N元素化合价由-3价升高到0价,由方程式可知生成1mol气体,转移6mol电子,则转移了 6.02×1023个电子时,生成0.5mol气体,体积为0.5mol×22.4L/mol=11.2L,
故答案为:11.2;
(4)氧化池中,也可用H2O2代替C1O2,反应后生成一种能使红色石蕊试纸变蓝的气体,为氨气,常见的酸式盐应为碳酸氢根离子,反应的离子方程式为CN-+H2O2+H2O=HCO3-+NH3↑,
故答案为:CN-+H2O2+H2O=HCO3-+NH3↑;
(5)电解池中,电解液使用Na[Ag(CN)2],在阴极上发生得电子的还原反应,即:[Ag(CN)2]-+e-=Ag+2CN-,工业电镀中使用氰离子,这样Ag+和CN-可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密,
故答案为:[[Ag(CN)2]-+e-=Ag+2CN-; Ag+和CN-可以结合生成稳定的[Ag(CN)2]-,以控制银离子浓度,使镀层致密.
点评 本题综合考查物质的分离、提纯,为高考常见题型,侧重考查利用氧化还原反应来实现废水的转化,涉及氧化还原反应等,明确该反应中的生成物是解本题关键,还可以结合原子守恒、转移电子守恒来分析解答,题目难度中等.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| A. | 100g质量分数为46%的乙醇水溶液中氧原子数为4NA | |
| B. | 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2 NA | |
| C. | 标准状况下,2.24LD2中所含中子的数目是0.2NA | |
| D. | 25℃时,KSP(BaSO4)=l×10-10,则BaSO4饱和溶液中Ba2+数目为l×10-5NA |
 常温下,向100mL 0.01mol•L-1 MOH溶液中逐滴加入0.02mo1•L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lgc(OH-).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1 MOH溶液中逐滴加入0.02mo1•L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lgc(OH-).下列说法中,不正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度大于K点水的电离程度 | |
| C. | 该温度下HA的电离平衡常数为5×10-6mo1•L-1 | |
| D. | 若K点对应溶液的pOH=10,则有c(HA)+c(H+)-c(OH-)=0.01mol•L-1 |
| A. | 燃煤时加入石灰石,可减少硫氧化物的排放 | |
| B. | 氯水中加入适量石灰石,可增强氯水的漂白性 | |
| C. | 酸性土壤中加入适量的熟石灰,可以中和其酸性 | |
| D. | 盐碱地(含较多NaCl、Na2CO3)中施用熟石灰,可降低土壤的碱性 |

| A. | 苯环上的一溴代物有6种 | B. | 该分子中的所有碳原子可能共平面 | ||
| C. | 该有机物的分子式为C16H17O5 | D. | l mol该有机物可消耗3molNaOH |
| A. | Fe$→_{高温}^{H_{2}O(g)}$Fe2O3$→_{高温}^{Al}$Al2O3 | |
| B. | Cu$→_{点燃}^{Cl_{2}}$CuCl2$\stackrel{FeCl_{3}(aq)}{→}$FeCl2 | |
| C. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
| A. | 推广使用清洁能源 | B. | 大力发展燃煤发电 | ||
| C. | 循环高效利用费源 | D. | 倡导环保低碳生活 |
| W | 某种氧化物是淡黄色固体 |
| X | 短周期中最高价氧化物对应水化物酸性最强 |
| Y | 第三周期中离子半径最小的 |
| Z | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| A. | W、Y、X的原子半径依次减小,Y、W、X简单离子的半径依次增大 | |
| B. | W、X、Y的最高价氧化物的水化物之间可以两两反应 | |
| C. | W的氧化物与Z的最高价氧化物反应一定是氧化还原反应 | |
| D. | 金属性W比Y强,非金属性Z比X弱 |
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 | B. | Na2O+H2O═2NaOH | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si |