题目内容
10.下列操作过程中,利用物质的氧化性的是( )| A. | 明矾净化水 | B. | 纯碱除去油污 | ||
| C. | 臭氧用于餐具消毒 | D. | 食醋清洗水垢 |
分析 物质表现氧化性,说明该物质在化学反应中得电子化合价降低,作氧化剂,发生氧化还原反应,以此解答.
解答 解:A.明矾水解生成具有吸附性的氢氧化铝胶体而达到净水的作用,不是氧化还原反应,故A不选;
B.纯碱溶液呈碱性,有利于油脂的水解,与氧化还原反应无关,故B不选;
C.利用臭氧的强氧化性而使蛋白质变性,所以臭氧可用于餐具消毒,故C选;
D.食醋具有酸性,与水垢中的氢氧化镁、碳酸钙都可反应,不是氧化还原反应,故D不选.
故选C.
点评 本题以物质的用途为载体考查了物质的氧化性,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20. 如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )
如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )
 如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )
如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )| ①Cu为阳极,Zn为阴极 ②Cu极上有气泡产生 ③SO42-向Cu极移动 ④若有0.5mol电子流经导线,可产生0.25mol气体 ⑤电子的流向是Cu→导线→Zn ⑥正极反应式:Cu+2e-═Cu2+ |
| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
1.关于如图所示装置的叙述,不正确的是( )
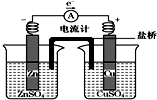

| A. | 盐桥是浸泡过KCl溶液的琼脂形成的,其中Cl-移向左池 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从铜片经导线流向锌片 | |
| D. | 铜离子在铜片表面被还原 |
18.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,11.2 L氯气所含原子数目为NA | |
| B. | 2 L 0.2 mol/L K2SO4溶液SO42-物质的量浓度为0.4 mol/L | |
| C. | 1 mol Na作还原剂可提供电子数为NA | |
| D. | 同温、同压下NA个CO2分子和NA个O2分子的体积相同 |
5.下列微粒具有氧化性的是( )
| A. | MnO4- | B. | Fe | C. | Cl- | D. | SO42- |
1.有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验,从实验可以判断( )


| A. | 该固体粉末中一定不含有BaCl2 | |
| B. | 该固体粉末中一定含有KNO3 | |
| C. | 它的组成可能是CaCO3、BaCl2、CuSO4 | |
| D. | 它的组成一定是CaCO3、Na2SO4、KNO3 |

