题目内容
10.黄铁矿既是硫矿又是铁矿,因其呈黄色俗称“愚人金”,是重要的工业原料.工业煅烧过程中常产生废渣,废渣成分主要含铁的几种氧化物和二氧化硅等,利用该废渣可以制备高效净水剂聚合硫酸铁,工艺流程如图: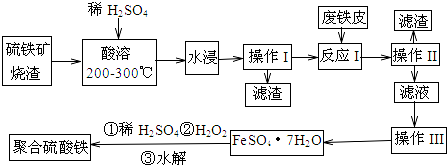
(1)检验“酸溶”后的溶液中含有Fe2+,试剂是KMnO4溶液.
(2)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是增大烧渣与硫酸的接触面积,加快烧渣的溶解.
(3)废铁皮使用前要用纯碱溶液浸泡,目的是洗去铁表面油污.
(4)“酸溶”过程中Fe2O3溶解的化学反应方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(5)“操作Ⅲ”系统操作名称依次为蒸发浓缩(加热浓缩)、冷却结晶、过滤和洗涤.洗涤的方法是向漏斗里加入蒸馏水,使水没过沉淀物,等水自然流完后,重复操作2~3次.
(6)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
分析 硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁,
(1)Fe2+具有还原性,可与KMnO4发生氧化还原反应;
(2)增大烧渣固体与硫酸的接触的表面积,可加快反应速率;
(3)碱性条件下,有利于油脂的水解;
(4)Fe2O3溶于硫酸生成硫酸铁和水;
(5)由溶液得到晶体FeSO4•7H2O,需蒸发浓缩、冷却结晶,洗涤的操作方法是向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2-3次;
(6)酸性条件下H2O2氧化Fe2+为Fe3+,同时双氧水被还原生成水.
解答 解:硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁,
(1)“酸溶”后的溶液中含有Fe3+和Fe2+,Fe2+具有还原性,所以检验Fe2+试剂是KMnO4 溶液,现象是紫红色褪去,
故答案为:KMnO4溶液;
(2)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是增大烧渣固体与硫酸的接触的表面积,加快烧渣的溶解速率,
故答案为:增大烧渣与硫酸的接触面积,加快烧渣的溶解;
(3)碱性条件下,有利于油脂的水解,废铁皮使用前要用纯碱溶液浸泡,目的是洗去铁表面油污,
故答案为:洗去铁表面油污;
(4)Fe2O3溶于硫酸生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(5)操作Ⅲ的目的是由溶液得到晶体FeSO4•7H2O,需蒸发浓缩、冷却结晶,洗涤的操作方法是向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2-3次,
故答案为:蒸发浓缩(加热浓缩)、冷却结晶;向漏斗里加入蒸馏水,使水没过沉淀物,等水自然流完后,重复操作2~3次;
(6)酸性条件下H2O2氧化Fe2+为Fe3+,同时双氧水被还原生成水,其反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
点评 本题考查制备实验方案的设计与评价,为高频考点和常见题型,题目难度中等,准确的分析流程、明确铁及其化合物的性质是解题的关键,侧重学生分析能力和创新能力的培养.

 阅读快车系列答案
阅读快车系列答案| A. | 还原性:Cr3+>Fe2+>SO2 | |
| B. | 氧化性:Cr2O72->SO2>Fe3+ | |
| C. | 足量的SO2也不能使Fe2(SO4)3溶液完全褪去颜色 | |
| D. | Fe2(SO4)3在前一个反应中做氧化剂,后一个反应中做还原剂 |
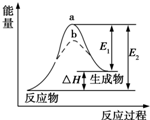
| A. | 如图可知a一定使用了催化剂 | |
| B. | 该反应为放热反应,△H=E1-E2 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 使用催化剂,可降低该反应的活化能 |
| A. | 566kJ | B. | 283kJ | C. | 712kJ | D. | 356kJ |
| A. | 等质量的氢气完全燃烧分别生成气态水和液态水,前者△H大于后者 | |
| B. | 破坏反应物全部化学键所需要的能量小于破坏生成物全部化学键所需要的能量时,该反应为吸热反应 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,可知含1molH2SO4的浓硫酸与含1molNaOH的烧碱溶液混合,放出热量等于57.3kJ | |
| D. | H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8kJ•mol-1 |
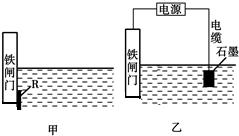 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一. 科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.
科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.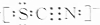 ,则SCN-中σ 键与π键的个数比为1:1.
,则SCN-中σ 键与π键的个数比为1:1.