题目内容
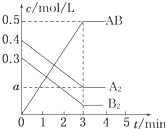 一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )
一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )| A、图中a点的值为0.15 |
| B、该反应的平衡常数K=0.03 |
| C、温度升高,平衡常数K值减小 |
| D、平衡时A2的转化率为62.5% |
考点:化学平衡的计算
专题:
分析:A、根据AB的浓度变化结合反应方程式计算A2的浓度变化,从而得出a值;
B、根据化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比进行计算;
C、根据放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小;
D、根据转化的A2的量和A2的初始量求算.
B、根据化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比进行计算;
C、根据放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小;
D、根据转化的A2的量和A2的初始量求算.
解答:
解:A、当AB的浓度改变0.5 mol?L-1,由方程式A2(g)+B2(g)?2AB(g)知,A2的浓度改变为0.25mol?L-1,所以a=(0.4-0.25)mol?L-1=0.15mol?L-1,即图中a点的值为0.15,故A正确;
B、当AB的浓度改变0.5 mol?L-1,由方程式知,B2的浓度改变为0.25mol?L-1,所以平衡时B2的浓度为=(0.3-0.25)mol?L-1=0.05mol?L-1,K=
=
=
,故B错误;
C、已知A2(g)+B2(g)?2AB(g)释放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小,故C正确;
D、当AB的浓度改变0.5 mol?L-1,由方程式知,A2的浓度改变为0.25mol?L-1,已知A2的初始量为0.4mol?L-1,所以平衡时A2的转化率为
×100%=62.5%,故D正确;
故选B.
B、当AB的浓度改变0.5 mol?L-1,由方程式知,B2的浓度改变为0.25mol?L-1,所以平衡时B2的浓度为=(0.3-0.25)mol?L-1=0.05mol?L-1,K=
| c 2(AB) |
| c(A 2)c(B 2) |
| 0.52 |
| 0.15×0.05 |
| 100 |
| 3 |
C、已知A2(g)+B2(g)?2AB(g)释放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小,故C正确;
D、当AB的浓度改变0.5 mol?L-1,由方程式知,A2的浓度改变为0.25mol?L-1,已知A2的初始量为0.4mol?L-1,所以平衡时A2的转化率为
| 0.25 |
| 0.4 |
故选B.
点评:本题考查化学反应速率、化学平衡的有关计算、平衡图象的分析,难度中等.

练习册系列答案
相关题目
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和方法不正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 碳酸钠溶液 | 分液 |
| D | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A、A | B、B | C、C | D、D |
 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )①C、CO ②AlCl2、Al(OH)3 ③Fe、Fe(NO3)2 ④NaCO3、NaHCO3.
| A、①②③④ | B、①②④ |
| C、③④ | D、①②③ |
下列溶液中Cl-浓度最小的是( )
| A、400mL1mol/L 盐酸 |
| B、200mL 2.5mol/L MgCl2溶液 |
| C、300mL 2mol/L AlCl3溶液 |
| D、100mL 3mol/L NaCl溶液 |
下列物质的用途,利用氧化还原反应的是( )
| A、用氯气消毒浴池 |
| B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) |
| C、用食盐腌渍食物 |
| D、用小苏打治疗胃酸过多 |