题目内容
10.物质的量相同的下列各组物质,分别在足量的O2中燃烧,所消耗O2 的量相同的一组是( )| A. | 乙醇、乙二醇 | B. | 丙醇、丁醇 | C. | 丙醇、丙烯 | D. | 丁醇、乙醛 |
分析 烃及含氧衍生物燃烧通式:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O,1mol有机物的耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,据此计算解答.
解答 解:A.1molC2H5OH耗氧量为(2+1.5-0.5)mol=3mol,1mol乙二醇(C2H6O2)耗氧量为(2+1.5-1)=2.5mol,故A不选;
B.1mol丙醇(C3H8O)耗氧量为(3+2-0.5)mol=4.5mol,1mol丁醇(C4H10O)耗氧量为(4+2.5-0.5)mol=6mol,故B不选;
C.1mol丙醇(C3H8O)耗氧量为(3+2-0.5)mol=4.5mol,1mol丙烯(C3H6)耗氧量为(3+1.5)mol=4.5mol,故C选;
D.1mol丁醇(C4H10O)耗氧量为(4+2.5-0.5)mol=6mol,1mol乙醛(C2H4O)耗氧量为(2+1-0.5)mol=1.5mol,故D不选;
故选C.
点评 本题考查有机物燃烧的计算,明确燃烧的通式及有机物的化学式是解答本题的关键,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
20. 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.
(1)甲醇常作燃料,已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1.(用含△H1、△H2、△H3的式子表示)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳可产生水煤气:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,能提高水煤气的生成速率的措施是AC.
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)将一定量的C (s)和H2O(g)通过某恒容的密闭容器中发生反应,得到如下数据:
通过计算,该反应的平衡常数为:0.25.
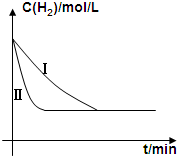
(4)工业上用水煤气来合成有机燃料,例如:CO(g)+2H2(g)$\stackrel{一定条件下}{?}$CH3OH(g)△H=-91kJ/mol某同学在不同实验条件下模拟化工生产进行实验,H2浓度随时间变化如图:
①实验I比实验II达到平衡所用的时间长.(填“长”“短”或“相等”)
②实验III比实验I的温度要高,其它条件相同,请在上图画出实验I和实验III中H2浓度随时间变化的示意图.
 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.(1)甲醇常作燃料,已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1.(用含△H1、△H2、△H3的式子表示)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳可产生水煤气:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,能提高水煤气的生成速率的措施是AC.
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)将一定量的C (s)和H2O(g)通过某恒容的密闭容器中发生反应,得到如下数据:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
(4)工业上用水煤气来合成有机燃料,例如:CO(g)+2H2(g)$\stackrel{一定条件下}{?}$CH3OH(g)△H=-91kJ/mol某同学在不同实验条件下模拟化工生产进行实验,H2浓度随时间变化如图:
①实验I比实验II达到平衡所用的时间长.(填“长”“短”或“相等”)
②实验III比实验I的温度要高,其它条件相同,请在上图画出实验I和实验III中H2浓度随时间变化的示意图.
1.下列对有机物结构或性质的描述,正确的是( )
| A. | 苯和氢气制环己烷;苯的硝化反应;属于同一反应类型 | |
| B. | 乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷属于同一反应类型 | |
| C. | 乙烷和丙烯混合物的物质的量为1mol,完全燃烧生成3molH2O | |
| D. | 一定条件下,乙醇可发生消去反应,甲醇也可发生消去反应 |
18.《华北电力大学学报:社会科学版》2014年第2期的文章《欧盟暂停征收航空碳排放税的法律思考》,该文章从欧盟暂停征收航空碳排放税的背景人手,分析了欧盟征收航空碳排放税的争议焦点所在,最后对欧盟暂停征收航空碳排放税进行了评析,并提出征收航空碳排放税是未来趋势的观点,希望在反对声中换一个视角来阐述征收航空碳排放税对于环境保护、技术革新和国际法的促进作用.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5C+4KMnO4+6H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O
(2)在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
①计算:K1=$\frac{9}{16}$.
②根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1大于T2 b.T1小于T2 c.无法比较
(3)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
已知:2H2O (g)═2H2(g)+O2(g)△H=+484kJ/mol,
①写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol.
②某温度下,在一容积可变的容器中,CO转化生成CO2的反应达到平衡时,CO、O2和CO2的物质的量分别为4mol、2mol、和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是:A.
A.均增加1mol B.均加倍 C.均减少1mol D.均减半
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①草酸氢钾溶液中存在如下平衡:
H2O?H++OH-、HC2O4-?H++C2O42-和HC2O4-+H2O?H2C2O4+OH-.
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad(填序号).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-) d.c(K+)>c(Na+)
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5C+4KMnO4+6H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O
(2)在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①计算:K1=$\frac{9}{16}$.
②根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1大于T2 b.T1小于T2 c.无法比较
(3)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
已知:2H2O (g)═2H2(g)+O2(g)△H=+484kJ/mol,
①写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol.
②某温度下,在一容积可变的容器中,CO转化生成CO2的反应达到平衡时,CO、O2和CO2的物质的量分别为4mol、2mol、和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是:A.
A.均增加1mol B.均加倍 C.均减少1mol D.均减半
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①草酸氢钾溶液中存在如下平衡:
H2O?H++OH-、HC2O4-?H++C2O42-和HC2O4-+H2O?H2C2O4+OH-.
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad(填序号).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-) d.c(K+)>c(Na+)
5.仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )
| 选项 | 实验目的 | 玻璃仪器 |
| A | 分离乙醇和乙酸的混合物 | 分液漏斗、烧杯、玻璃棒 |
| B | 用0.10mol/L的盐酸配制 100mL 0.050mol/的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C | 用溴水、淀粉KI溶液比较 Br2和I2的氧化性强弱 | 试管、胶头滴管 |
| D | 用NH4Cl固体和Ca(OH)2固体制备并收集NH3 | 酒精灯、烧杯、导管、集气瓶 |
| A. | A | B. | B | C. | C | D. | D |
15.常温下易溶于水,在一定条件下又能与水反应的是( )
| A. | 蔗糖 | B. | 氯乙烷 | C. | 植物油 | D. | 葡萄糖 |
5.下列有关钠、铁、铝性质的说法中不正确的是( )
| A. | 在地壳中的含量:Al>Fe>Na | |
| B. | 均能与盐酸反应,生成物中金属价态数值:Al>Fe>Na | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁 | |
| D. | 少量金属钠保存在煤油里 |
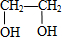 $→_{△}^{浓H_{2}SO_{4}}$ C
$→_{△}^{浓H_{2}SO_{4}}$ C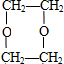 ;
;