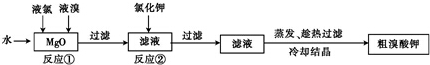
题目内容
5.下列说法正确的是( )| A. | 盐酸的导电能力一定大于醋酸 | |
| B. | 在氨水中加入无水醋酸,溶液的导电能力基本不变 | |
| C. | 在氢氧化钡的稀溶液中,c(OH-)=2c(Ba2+) | |
| D. | 在磷酸的稀溶液中,c(H+)=3c(PO43-) |
分析 A、导电能力和自由移动离子的浓度有关;
B、在氨水中加入无水醋酸,会发生反应生成醋酸铵,溶液的导电能力和自由移动离子的浓度有关;
C、氢氧化钡中氢氧根离子的物质的量是钡离子物质的量的2倍;
D、磷酸属于弱酸,不能完全电离.
解答 解:A、导电能力和自由移动离子的浓度有关,盐酸的导电能力不一定一定大于醋酸,故A错误;
B、在氨水中加入无水醋酸,会发生反应生成醋酸铵,醋酸铵属于强电解质,此过程溶液的导电能力会增加,故B错误;
C、在氢氧化钡的稀溶液中,氢氧根离子的物质的量是钡离子物质的量的2倍,即c(OH-)=2c(Ba2+),故C正确;
D、磷酸属于弱酸,不能完全电离,稀溶液中,c(H+)≠3c(PO43-),故D错误.
故选C.
点评 本题涉及电解质的导电能力强弱的判断、弱电解质的电离等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
15.下列各组物质的转化关系中,不全部是通过一步反应完成的是( )
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Na→Na2O2→Na2CO3→NaCl | ||
| C. | Fe→FeCl3→Fe(OH)3→Fe2O3 | D. | Al→Al2O3→AlCl3→Al(OH)3 |
13. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成以下实验设计表中横线上的内容.
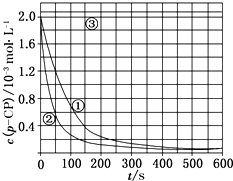
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
(2)根据如图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1. (3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成以下实验设计表中横线上的内容.
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
(2)根据如图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1. (3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
20.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 常温下,1L 0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cu2+个数小于0.5NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移电子数为1.5NA |
10.设NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 标准状况下,11.2L N2O4中含有的分子数目为0.5NA | |
| B. | 常温常压下,10.4g苯乙烯中含有的碳碳双键数目为0.1NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA | |
| D. | 常温常压下,0.1mol单质硅和二氧化硅中含有的共价键数目都是0.2NA |
17.在通常条件下,下列各组物质的比较排列不正确的是( )
| A. | 沸点:正戊烷>2-甲基丁烷>乙烷 | B. | 同分异构体种类:戊烯<戊烷 | ||
| C. | 密度:苯<水<硝基苯 | D. | 含碳量:乙烯>乙烷 |
3.硼有两种天然同位素${\;}_5^{10}$B和${\;}_5^{11}$B,硼元素的近似相对原子质量为10.80,则对硼元素中${\;}_5^{10}$B的物质的量分数的判断正确的是( )
| A. | 10% | B. | 20% | C. | 50% | D. | 80% |
4.对充有氖气的霓虹灯管通电,灯管发出红色光,产生这一现象的主要原因( )
| A. | 在电流的作用下,氖原子与构成灯管的物质发生反应 | |
| B. | 电子由激发态向基态跃迁时以光的形式释放能量 | |
| C. | 氖原子获得电子后转变成发出红光的物质 | |
| D. | 电子由基态向激发态跃迁时吸收除红光以外的光线 |