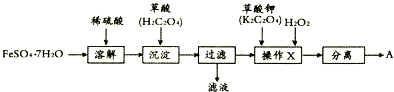
题目内容
10.CH4和CO2混合气体的密度与同温同压下NO的密度相同,混合气体中CH4和CO2的质量比为( )| A. | 1:1 | B. | 5:3 | C. | 33:11 | D. | 11:4 |
分析 CO2、CH4组成的混合气在同温同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,则二氧化碳与甲烷的平均相对分子质量为28,即满足二氧化碳与甲烷的平均相对分子质量为28即可,根据十字交叉法计算CO2、CH4的物质的量之比.以此解答判断.
解答 解:CO2、CH4组成的混合气在同温同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,则二氧化碳与甲烷的平均相对分子质量为28,即满足二氧化碳与甲烷的平均相对分子质量为28即可,
利用十字相乘法得二氧化碳和氢气的物质的量之比:
二氧化碳和甲烷的物质的量之比为12:16=3:4,质量之比为3×44:4×16=33:11,
故选:C.
点评 本题考查混合物的计算,题目难度不大,注意有关计算公式的运用,可以利用十字交叉法计算二者物质的量之比.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
15.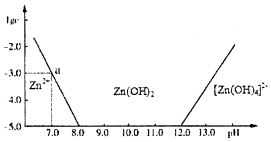 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
根据上表数据判断下列说法正确的是C D.
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
2.在100mL 0.5mol/L AlCl3溶液中,加入100mL NaOH 溶液,得到2.34g 沉淀.则NaOH溶液物质的量浓度是(单位:mol/L)( )
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
19.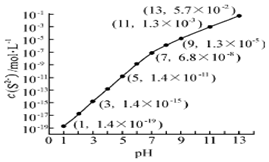 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.
(1)①硫离子的电子式为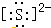 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发),
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
①等浓度的NaHSO3和Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(H+)>c(HSO3-)>c(OH-).
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.(1)①硫离子的电子式为
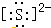 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发),
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
20.相同温度下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.下列判断不正确的是( )
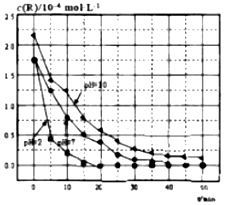

| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |