题目内容
7.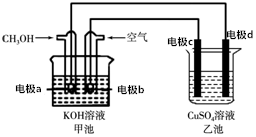 用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )
用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )| A. | 甲池化学能转化为电能,工作时OH-由a→b定向移动 | |
| B. | 通电时,整个电路中电流方向为b→c,d→a | |
| C. | 乙池中CuSO4溶液的浓度不变 | |
| D. | 电极d是纯铜,此过程中电子转移0.05mol |
分析 甲为原电池,通入甲醇的电极是负极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,通入空气的一极为正极,乙为电解池,c为阳极,电极为粗铜,d为阴极,电极为纯铜,以此解答该题.
解答 解:A.甲为原电池,工作时阴离子向负极移动,a为负极,故A错误;
B.a为负极,b为正极,电流经外电路由b流向c,由d流向a,故B正确;
C.乙池为粗铜的电解精炼,粗铜电极上Cu和其它金属失电子、纯铜上析出的物质只有Cu,所以溶液中铜离子减少,则溶液中铜离子浓度降低,故C错误;
D.质量增加的为阴极,析出铜,电极方程式为Cu2++2e-=Cu,电极质量增加了3.2g,为0.05molCu,则电子转移0.1mol,故D错误.
故选B.
点评 本题考查了原电池和电解池原理,为高频考点,侧重考查学生分析计算能力,明确各个电极上发生的电极反应式是解本题关键,注意电极方程式的书写,难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
4.下列实验中红,对应的实验现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸测定等浓度的HCl、H2SO4两溶液的pH | 测定HCl溶液的pH试纸更红 | 非金属性Cl>S |
| B | 将AgCl和AgBr的饱和溶液等体积混合 | 出现淡黄色沉淀 | Ksp(AgBr)<Ksp(AgCl) |
| C | 向Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | A l(OH)3 不溶于氢氧化钡溶液 |
| D | 将Fe(NO3)2 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)3 样品溶于稀硫酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
15.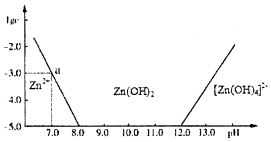 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
根据上表数据判断下列说法正确的是C D.
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
2.在100mL 0.5mol/L AlCl3溶液中,加入100mL NaOH 溶液,得到2.34g 沉淀.则NaOH溶液物质的量浓度是(单位:mol/L)( )
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
19.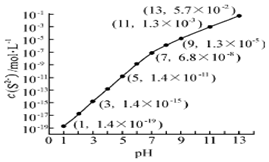 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.
(1)①硫离子的电子式为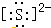 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发),
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
①等浓度的NaHSO3和Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(H+)>c(HSO3-)>c(OH-).
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.(1)①硫离子的电子式为
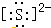 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发),
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
16.某有机物的结构简式为 ,与其互为同分异构体的是( )
,与其互为同分异构体的是( )
 ,与其互为同分异构体的是( )
,与其互为同分异构体的是( )| A. |  | B. |  | C. |  | D. |  |
17.设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| B. | 32 g Cu和32 g S充分反应,转移的电子数为0.5NA | |
| C. | 1 mol Si中含有共价键数目为4NA | |
| D. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA |
 ,
, O2-
O2- .
.