��Ŀ����
��2013���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ������β����������Ҫԭ��Ϊ��2NO��g��+2CO��g��
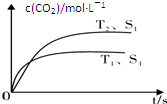
2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ��ʾ��
�ݴ��жϣ�
��1���÷�Ӧ�ġ�H 0��ѡ�����������������
��2������һ���¶��£���1.0mol NO��0.5mol CO����0.5L�̶��ݻ��������У��ﵽƽ��ʱNO��CO��CO2��N2���ʵ����ֱ�Ϊ��0.8mol��0.3mol��0.2mol��0.1mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��ΪK= ���������¶Ȳ��䣬���������г���CO��N2��0.3mol��ƽ�⽫ �ƶ���ѡ����������ҡ���������
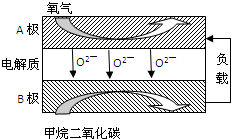
���Լ���Ϊȼ�ϵ����͵�أ���ɱ�������������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ��
�ش��������⣺
��1��B��Ϊ��ؼ� ���缫��ӦʽΪ ��
��2�����ø�ȼ�ϵ������Դ����ʯī���缫���100mL 1mol/L������ͭ��Һ���������ռ���������������ʱ�����������ĵļ�������Ϊ������£� ��
��FeS������Һ�д��ڣ�FeS��s��?Fe2+��aq��+S2-��aq����Ksp=c��Fe2+��?c��S2-����������Ksp=1.0��10-16����֪FeS������Һ��c��H+����c��S2-��֮���������������ϵ��[c��H+��]2?c��S2-��=1.0��10-22��Ϊ��ʹ��Һ��c��Fe2+���ﵽ1mol/L���ֽ�����FeSͶ���䱥����Һ�У�Ӧ������Һ�е�pHΪ ��
| ���� |

�ݴ��жϣ�
��1���÷�Ӧ�ġ�H
��2������һ���¶��£���1.0mol NO��0.5mol CO����0.5L�̶��ݻ��������У��ﵽƽ��ʱNO��CO��CO2��N2���ʵ����ֱ�Ϊ��0.8mol��0.3mol��0.2mol��0.1mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��ΪK=
���Լ���Ϊȼ�ϵ����͵�أ���ɱ�������������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ��

�ش��������⣺
��1��B��Ϊ��ؼ�
��2�����ø�ȼ�ϵ������Դ����ʯī���缫���100mL 1mol/L������ͭ��Һ���������ռ���������������ʱ�����������ĵļ�������Ϊ������£�
��FeS������Һ�д��ڣ�FeS��s��?Fe2+��aq��+S2-��aq����Ksp=c��Fe2+��?c��S2-����������Ksp=1.0��10-16����֪FeS������Һ��c��H+����c��S2-��֮���������������ϵ��[c��H+��]2?c��S2-��=1.0��10-22��Ϊ��ʹ��Һ��c��Fe2+���ﵽ1mol/L���ֽ�����FeSͶ���䱥����Һ�У�Ӧ������Һ�е�pHΪ
���㣺���ʵ�����Ũ����ʱ��ı仯����,��Ӧ�Ⱥ��ʱ�,��ѧ��Դ���͵��,���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���
ר�⣺�����������������
��������1�����ݵ���ƽ���ʱ���ж��¶ȸߵͣ�����ƽ��ʱ������̼��Ũ���ж��¶ȶ�ƽ���Ӱ�죬�����жϡ�H��
��2����������ʽ����ƽ��ʱ����ֵ�Ũ�ȣ�Ȼ��������ʽ��⣻���ʱ��Ũ������ƽ�ⳣ���Ĵ�С��ϵ�����жϣ�
��1��BΪ�������ܷ�ӦʽΪCH4+2O2+=CO2+2H2O��������ӦʽΪ��2O2+8e-=4O2-����ʽ����ɵø����缫��Ӧʽ��
��2����ʼ�η�����Ӧ��2Cu2++2H2O
2Cu+O2��+4H+��ͭ������ȫ�ŵ������Ӧ2H2O
2H2��+O2�����������ռ���������������ʱ���������������������ȣ���������Ϊxmol�����ݵ���ת���غ��з��̼��㣬�ٸ��ݵ���ת���غ�������ĵļ��飻
�������������ܶȻ���������������Ũ�ȼ���������Ũ�ȣ��ٸ���������ĵ���ƽ�ⳣ������������Ũ�ȣ��������pH���㹫ʽ������Һ��pH��
��2����������ʽ����ƽ��ʱ����ֵ�Ũ�ȣ�Ȼ��������ʽ��⣻���ʱ��Ũ������ƽ�ⳣ���Ĵ�С��ϵ�����жϣ�
��1��BΪ�������ܷ�ӦʽΪCH4+2O2+=CO2+2H2O��������ӦʽΪ��2O2+8e-=4O2-����ʽ����ɵø����缫��Ӧʽ��
��2����ʼ�η�����Ӧ��2Cu2++2H2O
| ||
| ||
�������������ܶȻ���������������Ũ�ȼ���������Ũ�ȣ��ٸ���������ĵ���ƽ�ⳣ������������Ũ�ȣ��������pH���㹫ʽ������Һ��pH��
���
�⣺��1������ͼ��֪���¶�T1�ȵ���ƽ�⣬���¶�T1��T2���¶�Խ��ƽ��ʱ��������̼��Ũ��Խ�ͣ�˵�������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0��
�ʴ�Ϊ������
��2��2NO+2CO?2CO2 +N2
ƽ���Ũ�ȣ�1.6 0.6 0.4 0.2
����K=
=5/144 ��0.0347��
�����������CO��N2��0.3mol��Q=
=0.0347=K������ƽ�ⲻ�ƶ����ʴ�Ϊ��0.0347������
II����1���ܷ�ӦʽΪCH4+2O2+=CO2+2H2O��������ӦʽΪ��2O2+8e-=4O2-����ʽ�����������ӦΪ��CH4-8e-+4O2-=CO2+2H2O��
�ʴ�Ϊ��������CH4-8e-+4O2-=CO2+2H2O��
��2������ͭ�����ʵ���=0.1L��1mol/L=0.1mol����ʼ�η�����Ӧ��2Cu2++2H2O
2Cu+O2��+4H+��ͭ������ȫ�ŵ������Ӧ2H2O
2H2��+O2�����������ռ���������������ʱ���������������������ȣ���������Ϊxmol�����ݵ���ת���غ㣬��0.1mol��2+2x=4x�����x=0.1��
���ݵ���ת���غ㣬��֪���ĵļ������ʵ���=
=0.05mol�������ļ�������=0.05mol��22.4L/mol=1.12L��
�ʴ�Ϊ��1.12L��
III����3����Һ��c��S2-��=
=
=1.0��10-16mol/L��c2��H+��?c��S2-��=1.0��10-22����c��H+��=
=10-3mol/L��pH=-lg10-3=3��
�ʴ�Ϊ��3��
�ʴ�Ϊ������
��2��2NO+2CO?2CO2 +N2
ƽ���Ũ�ȣ�1.6 0.6 0.4 0.2
����K=
| 0��42��0.2 |
| 1��62��0��62 |
�����������CO��N2��0.3mol��Q=
| 0��42��0.8 |
| 1��62��1��22 |
II����1���ܷ�ӦʽΪCH4+2O2+=CO2+2H2O��������ӦʽΪ��2O2+8e-=4O2-����ʽ�����������ӦΪ��CH4-8e-+4O2-=CO2+2H2O��
�ʴ�Ϊ��������CH4-8e-+4O2-=CO2+2H2O��
��2������ͭ�����ʵ���=0.1L��1mol/L=0.1mol����ʼ�η�����Ӧ��2Cu2++2H2O
| ||
| ||
���ݵ���ת���غ㣬��֪���ĵļ������ʵ���=
| 0.1mol��4 |
| 8 |
�ʴ�Ϊ��1.12L��
III����3����Һ��c��S2-��=
| Ksp |
| c(Fe2+) |
| 1.0��10-16 |
| 1 |
|
�ʴ�Ϊ��3��
�����������ۺϢ��п����˻�ѧƽ���ƶ���ƽ�ⳣ������ؼ��㡢����ע�����õ���ת���غ���㣬��Ŀ����������ܴ�˼ά����ѧ�������������кܸߵ�Ҫ���ѶȺܴ�����ܶȻ�����������ĵ���ƽ�ⳣ��������Һ��pH����Ŀ�Ѷ��еȣ���

��ϰ��ϵ�д�
�����Ŀ
���л�ѧ��Ӧ���Ƿ��ȷ�Ӧ��ͬʱ����������ԭ��Ӧ���ǣ�������
| A��������̼������̼���ʸ����µķ�Ӧ |
| B����ˮ�����������������Ȼ�粒���ķ�Ӧ |
| C������кͷ�Ӧ |
| D���������ƹ����������̼����ķ�Ӧ |
�������з�Ӧ�����Ƶ������д������ʵ��ǣ�������
| A����ϩ��ˮ��Ӧ���Ҵ��� |
| B����ϩ��������Ӧ��1��2-�������飩 |
| C��Һ���뱽���廯����������Ӧ���屽�� |
| D�������ʵ����������������ڹ��������·�Ӧ�������飩 |
 ������Ũ��ˮ��Ӧ�Ļ�ѧ����
������Ũ��ˮ��Ӧ�Ļ�ѧ����