题目内容
15.乙烯的产量是衡量一个国家石油化工发展水平的重要标志.I.将8.96L (标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应,溴的四氯化碳溶液的质量增加8.4g,则原气体混合物中乙烯与乙烷的物质的量之比为3:1.
II.以乙烯为原料合成化合物C的流程如图所示:

(1)写出A的结构简式:CH2ClCH2Cl.
(2)①、④的反应类型分别为加成反应、酯化(取代)反应.
(3)写出反应②和④的化学方程式:
②2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
④2CH3COOH+HOCH2-CH2OH$?_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O.
分析 Ⅰ.乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,根据n=$\frac{m}{M}$计算乙烯的物质的量,n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,进而计算乙烷的物质的量,可计算两种气体的物质的量之比;
Ⅱ.由流程图可知:乙烯与氯气发生加成反应生成物质A,则A为:1,2-二氯乙烷,1,2-二氯乙烷水解生成乙二醇;乙烯与水反应生成乙醇,乙醇发生催化氧化得到物质B,则B为乙醛,乙醛催化氧化得到乙酸;乙酸与乙二醇在浓硫酸条件下发生酯化反应生成二乙酸乙二酯,以此解答该题.
解答 解:I、8.96L 混合气体的物质的量为n=$\frac{8.96L}{22.4L/mol}$=0.4mol,
乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,所以乙烯的物质的量为n=$\frac{8.4g}{28g/mol}$=0.3mol,
则乙烷的物质的量为:0.4mol-0.3mol=0.1mol,
原气体混合物中乙烯与乙烷的物质的量之比为3:1,
故答案为:3:1;
II、(1)A为1,2-二氯乙烷,结构简式为CH2ClCH2Cl,故答案为:CH2ClCH2Cl;
(2)反应①为乙烯在催化剂条件下与水发生加成反应生成乙醇;反应④为乙二醇与乙酸在一定条件下发生酯化反应,有也属于取代反应,
故答案为:加成反应;酯化(取代);
(3)反应②为乙醇催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
反应④为乙二醇与乙酸发生酯化反应生成C,由C的分子式可知,应是1分子乙二醇与2分子乙酸反应,则C为二乙酸乙二酯(CH3COOCH2CH2OOCCH3),反应方程式为:2CH3COOH+HOCH2-CH2OH$?_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;2CH3COOH+HOCH2-CH2OH$?_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O.
点评 本题考查有机推断题,为高频考点,题目难度中等,涉及官能团名称、物质的结构简式的书写、化学反应的类型判断、化学方程式的书写等知识,熟悉各种物质的结构和性质是解题关键,试题知识点较多,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

 名校课堂系列答案
名校课堂系列答案| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量醋酸钠晶体,两溶液pH均增大 | |
| B. | ①与②两溶液中:c(NH4+)>c(Na+) | |
| C. | 分别加水稀释10倍,溶液的pH:①>②>④>③ | |
| D. | V1L①和V2L④溶液混合后,若pH=7,则V1>V2 |
| A. | 淀粉、油脂和蛋白质都是高分子化合物,且它们都是混合物 | |
| B. | 淀粉、纤维素和葡萄糖都能发生水解反应 | |
| C. | 乙醛、乙酸和葡萄糖都能与新制的氢氧化铜悬浊液发生氧化反应 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
| A. | 4 mol/L | B. | 4mol/(L•S) | C. | 0.8 mol/L | D. | 0.8 mol/(L•S) |
| A. | 绿色化学的核心是对环境污染进行综合治理 | |
| B. | Al2O3可用作耐火材料 | |
| C. | 地沟油经处理后可用作燃料油 | |
| D. | 胶体和溶液的本质区别是分散质粒子直径大小 |

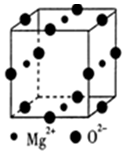 碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.
碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.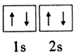 ;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).
;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).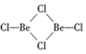 )的形式存在,在1000℃,氯化铍则以BeCl2形式存在.
)的形式存在,在1000℃,氯化铍则以BeCl2形式存在.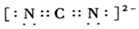 .
.