题目内容
已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10 ,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)请写出括号内物质的化学式:
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是 的影响.
(1)请写出括号内物质的化学式:
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是
考点:氧化还原反应方程式的配平,化学反应速率的影响因素
专题:氧化还原反应专题,化学反应速率专题
分析:(1)根据质量守恒确定未知物化学式;
(2)锰离子有催化作用.
(2)锰离子有催化作用.
解答:
解:(1)根据质量守恒,反应物含O原子个数共40个,含碳10个,反应后已知产物含O原子总数为:20个,含碳为0个,故未知物中含氧原子20个,含碳原子10个,故未知物为二氧化碳,化学式为:CO2,故答案为:CO2;
(2)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,
故答案为:催化剂;
(2)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,
故答案为:催化剂;
点评:本题考查了氧化还原反应的配平及影响反应速率的因素,难度较小,要把握质量守恒定律的应用.

练习册系列答案
相关题目
常温下,pH=1的盐酸与pH=12的NaOH溶液恰好完全反应,二者的体积比为( )
| A、1:1 | B、10:1 |
| C、100:1 | D、1:10 |
向NaAlO2溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是( )
| A、NO2 |
| B、CO2 |
| C、NH3 |
| D、CO |
在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol?L-1下列判断正确的是( )
| A、x=1 |
| B、达到平衡时,在相同温度下容器内混合气体的压强是反应前的8.5倍 |
| C、平衡时A的浓度为1.50?L-1 |
| D、B的转化率为20% |
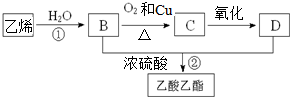
 运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.
运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义. “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题: