题目内容
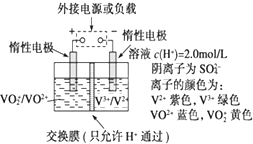 全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.①当左槽溶液颜色逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由
③放电过程中氢离子的作用是
考点:原电池和电解池的工作原理
专题:
分析:①左槽溶液逐渐由黄变蓝,VO2+转变为VO2+,发生还原反应,应为原电池的正极,
②充电过程中,右槽连接电源的负极,发生还原反应,为电解池的阴极,电极反应式为V3++e-=V2+,
③充电时,左槽发生的反应为VO2++H2O-e-=VO2++2H+当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5 mol;
②充电过程中,右槽连接电源的负极,发生还原反应,为电解池的阴极,电极反应式为V3++e-=V2+,
③充电时,左槽发生的反应为VO2++H2O-e-=VO2++2H+当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5 mol;
解答:
解:①当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极,故答案为:VO2++2H++e-=VO2++H2O;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,
故可以看到右槽溶液颜色逐渐由绿色变为紫色.
故答案为:绿,紫;
③放电过程中,电极反应式为VO2++2H++e-=VO2++H2O,氢离子的作用是充电时,参与正极反应,通过交换膜定向移动使电流通过溶液;左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5mol;氢离子变化0.5mol;
故答案为:参与正极反应,通过交换膜定向移动使电流通过溶液;0.5mol;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,
故可以看到右槽溶液颜色逐渐由绿色变为紫色.
故答案为:绿,紫;
③放电过程中,电极反应式为VO2++2H++e-=VO2++H2O,氢离子的作用是充电时,参与正极反应,通过交换膜定向移动使电流通过溶液;左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5mol;氢离子变化0.5mol;
故答案为:参与正极反应,通过交换膜定向移动使电流通过溶液;0.5mol;
点评:本题考查了电解池中,与电源正极相连为阳极,发生氧化反应,失去电子,与电源负极相连的阴极,发生还原反应,得到电子,并且根据得失电子守恒计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法不正确的是( )
A、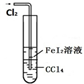 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
B、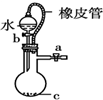 橡皮管的作用是使水能顺利流下 |
C、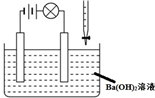 若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮 |
D、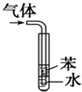 用于吸收HCl气体能防倒吸 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
下列关于反应热及能量变化的说法正确的是( )
| A、当△H<0时,表示该反应为吸热反应 |
| B、放热反应可以自发进行,而吸热反应需加热才能进行 |
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D、化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
下列有机物属于烃类的是( )
| A、CH3COOH |
| B、CH2═CH2 |
| C、CH3COOCH2CH3 |
| D、CH3CH2OH |
