题目内容
有位于元素周期表前四周期A,B,C,D,E,F,G七种原子序数依次增大的元素.已知:
①A是周期表中原子半径最小的元素,A,D位于同一主族
②B和C两种元素在周期表中位置相邻,在不同条件下可形成BC和BC2两种气态化合物
③E的最外层电子数是C的价电子数的一半
④F的单质是一种淡黄色固体
⑤G属于过渡元素,是日常生活中应用最广泛的金属之一,且G有几种不同价态的氧化物,其中一种有磁性,
请回答下列问题:
(1)写出由C,D两种元素组成的具有非极性键的物质的电子式是 写出元素G基态原子的电子排布式 BA3分子中的B-A共价键的键能 (填“大于”或“小于”)A2 F分子中的A-F共价键的键能
(2)选择D的最高价氧化物对应的水化物作电解质溶液和单质E,G作两个电极,可构成原电池,
(用元素符号表示)作负极,G电极上的现象:
(3)由A,B,C三种元素形成的离子化合物溶于水后,溶液的pH (填大于,等于或小于)7,理由是 (用离子方程式表示)
(4)G的+2价氧化物和E在高温条件下反应的化学方程式
(5)0.5mol单质A在氧气中燃烧放出142.9KJ的热量,请写出单质A燃烧热的热化学方程式 .
①A是周期表中原子半径最小的元素,A,D位于同一主族
②B和C两种元素在周期表中位置相邻,在不同条件下可形成BC和BC2两种气态化合物
③E的最外层电子数是C的价电子数的一半
④F的单质是一种淡黄色固体
⑤G属于过渡元素,是日常生活中应用最广泛的金属之一,且G有几种不同价态的氧化物,其中一种有磁性,
请回答下列问题:
(1)写出由C,D两种元素组成的具有非极性键的物质的电子式是
(2)选择D的最高价氧化物对应的水化物作电解质溶液和单质E,G作两个电极,可构成原电池,
(3)由A,B,C三种元素形成的离子化合物溶于水后,溶液的pH
(4)G的+2价氧化物和E在高温条件下反应的化学方程式
(5)0.5mol单质A在氧气中燃烧放出142.9KJ的热量,请写出单质A燃烧热的热化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A是周期表中原子半径最小的元素,则A是氢元素,A,B,C,D,E,F,G七种原子序数依次增大的元素,A,D位于同一主族,则A是钠元素,B和C两种元素在周期表中位置相邻,在不同条件下可形成BC和BC2两种气态化合物,是NO和NO2,所以B和C分别为氮和氧元素,E的最外层电子数是C的价电子数的一半,最外3个电子,是第三周期的铝,F的单质是一种淡黄色固体,是硫,G属于过渡元素,是日常生活中应用最广泛的金属之一,且G有几种不同价态的氧化物,其中一种有磁性,是铁元素,由此分析解题.
解答:
解:A是周期表中原子半径最小的元素,则A是氢元素,A,B,C,D,E,F,G七种原子序数依次增大的元素,A,D位于同一主族,则A是钠元素,B和C两种元素在周期表中位置相邻,在不同条件下可形成BC和BC2两种气态化合物,是CO和CO2,所以B和C分别为碳和氧元素,E的最外层电子数是C的价电子数的一半,最外3个电子,是第三周期的铝,F的单质是一种淡黄色固体,是硫,G属于过渡元素,是日常生活中应用最广泛的金属之一,且G有几种不同价态的氧化物,其中一种有磁性,是铁元素,(1)由氧和钠两种元素组成的具有非极性键的物质是过氧化钠,其电子式为: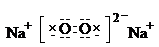 ;铁的基态原子的电子排布式为:1s22s22p63s23p63d64s2,同主族从上往下非金属性减弱,非金属性越强,形成氢化物的键能越大,O的非金属性强S,所以H-O的键能大于H-S,
;铁的基态原子的电子排布式为:1s22s22p63s23p63d64s2,同主族从上往下非金属性减弱,非金属性越强,形成氢化物的键能越大,O的非金属性强S,所以H-O的键能大于H-S,
故答案为: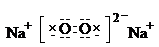 ;1s22s22p63s23p63d64s2;大于;
;1s22s22p63s23p63d64s2;大于;
(2)钠的最高价氧化物对应的水化物是氢氧化钠,铁和铝在碱溶液中铝活泼,所以铝作负极,G作正极,水电离出氢离子在正极上放电,生成氢气,电极上的现象有大量气泡产生,故答案为:Al;有大量气泡产生;
(3)由A,B,C三种元素形成的离子化合物是硝酸铵,强酸弱碱盐溶于水水解使溶液呈酸性,故答案为:小于;NH4++H2O?NH3.H2O+H+;
(4)铁的+2价氧化物FeO和Al在高温条件下发生铝热反应的化学方程式为:3FeO+2Al
Al2O3+3Fe,故答案为:3FeO+2Al
Al2O3+3Fe;
(5)0.5mol氢气在氧气中燃烧,释放出142.9kJ热量,则1molH2完全燃烧生成液态水放出的热量为285.8kJ,
反应的热化学方程式为H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol.
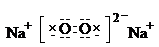 ;铁的基态原子的电子排布式为:1s22s22p63s23p63d64s2,同主族从上往下非金属性减弱,非金属性越强,形成氢化物的键能越大,O的非金属性强S,所以H-O的键能大于H-S,
;铁的基态原子的电子排布式为:1s22s22p63s23p63d64s2,同主族从上往下非金属性减弱,非金属性越强,形成氢化物的键能越大,O的非金属性强S,所以H-O的键能大于H-S,故答案为:
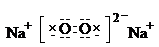 ;1s22s22p63s23p63d64s2;大于;
;1s22s22p63s23p63d64s2;大于;(2)钠的最高价氧化物对应的水化物是氢氧化钠,铁和铝在碱溶液中铝活泼,所以铝作负极,G作正极,水电离出氢离子在正极上放电,生成氢气,电极上的现象有大量气泡产生,故答案为:Al;有大量气泡产生;
(3)由A,B,C三种元素形成的离子化合物是硝酸铵,强酸弱碱盐溶于水水解使溶液呈酸性,故答案为:小于;NH4++H2O?NH3.H2O+H+;
(4)铁的+2价氧化物FeO和Al在高温条件下发生铝热反应的化学方程式为:3FeO+2Al
| ||
| ||
(5)0.5mol氢气在氧气中燃烧,释放出142.9kJ热量,则1molH2完全燃烧生成液态水放出的热量为285.8kJ,
反应的热化学方程式为H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题考查无机物的推断以及元素周期表与周期律的综合应用,题目考查角度较多,题目难度较大,注意把握相关物质的性质,为解答该题的关键.

练习册系列答案
相关题目
将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g).反应经过10min达到平衡,测得c(SO3)=0.4mol/L、c(SO2)=0.1mol/L,则下列叙述中不正确的是( )
| A、容器里气体的密度为40 g/L |
| B、SO3的分解率为20% |
| C、在这10 min内的平均速率为υ(O2)=0.005 mol?L-1?min-1 |
| D、化学反应速率:υ(Ag2SO4)=υ(SO3) |
乙醇分子结构中的各种化学键如图所示,下列关于乙醇在各种反应中断键的说法正确的是( )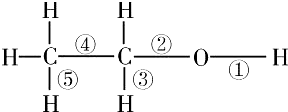

| A、与醋酸、浓硫酸共热时断裂① |
| B、在空气中燃烧时断裂④⑤ |
| C、和金属钠反应时断裂② |
| D、在Cu催化下和O2反应时断裂②③ |
 .化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
.化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.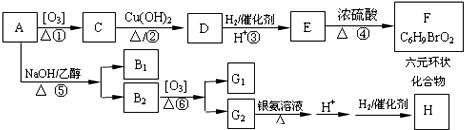
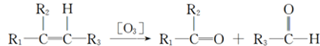
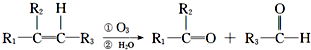
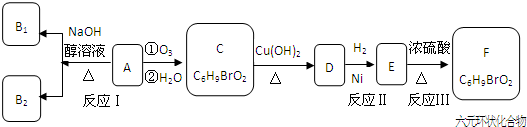
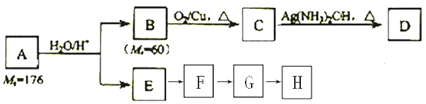 ,其中H为
,其中H为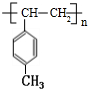 ,
,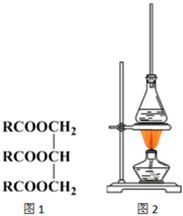 油脂是高级脂肪酸的甘油酯,其结构可以表示为图1(R为相同基团).利用油脂的皂化反应和滴定法可以测定油脂的平均分子量.回答下列问题:
油脂是高级脂肪酸的甘油酯,其结构可以表示为图1(R为相同基团).利用油脂的皂化反应和滴定法可以测定油脂的平均分子量.回答下列问题: