题目内容
将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g).反应经过10min达到平衡,测得c(SO3)=0.4mol/L、c(SO2)=0.1mol/L,则下列叙述中不正确的是( )
| A、容器里气体的密度为40 g/L |
| B、SO3的分解率为20% |
| C、在这10 min内的平均速率为υ(O2)=0.005 mol?L-1?min-1 |
| D、化学反应速率:υ(Ag2SO4)=υ(SO3) |
考点:化学平衡的计算
专题:化学平衡专题
分析:已知①Ag2SO4(s)?Ag2O(s)+SO3(g),②2SO3(g)?2SO2(g)+O2(g),平衡时c (SO2)=0.1mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,以此解答该题.
解答:
解:已知①Ag2SO4(s)?Ag2O(s)+SO3(g),②2SO3(g)?2SO2(g)+O2(g),平衡时c (SO2)=0.1mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,
A.c (SO2)=0.1mol/L,则c (O2)=0.05mol/L,设容器体积为1L,则容器里气体的密度为
=40g/L,故A正确;
B.反应②中SO3的分解率为
×100%=20%,故B正确;
C.平衡时c (SO2)=0.1mol/L,则c(O2)=0.05mol/L,在这10min内平衡时氧气的反应速率=
=0.005mol/(L?min),故C正确;
D.因为纯固体不可以用来表示反应速率,所以υ(Ag2SO4)表达错误,故D错误.
故选D.
A.c (SO2)=0.1mol/L,则c (O2)=0.05mol/L,设容器体积为1L,则容器里气体的密度为
| 0.4mol/L×1L×80g/mol+0.1mol/L×1L×64g/mol+0.05mol/L×1L×32g/mol |
| 1L |
B.反应②中SO3的分解率为
| 0.1mol/L |
| 0.5mol/L |
C.平衡时c (SO2)=0.1mol/L,则c(O2)=0.05mol/L,在这10min内平衡时氧气的反应速率=
| 0.05mol/L |
| 10min |
D.因为纯固体不可以用来表示反应速率,所以υ(Ag2SO4)表达错误,故D错误.
故选D.
点评:本题考查化学平衡的计算,题目难度不大,注意根据两个反应的浓度关系结合方程式进行计算,易错点为D,注意纯固体不可以用来表示反应速率.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列化学用语或模型表示不正确的是( )
A、硝基苯的结构简式: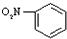 |
| B、葡萄糖的实验式(最简式)为:C6H12O6 |
C、乙酸的分子比例模型图为: |
D、CH3Cl的电子式: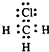 |
下在无土栽培中,需配制一定组成的植物营养液.已知某植物营养液的配方为0.3molKCl、0.2molK2SO4、0.1molZnSO4和1LH2O.若用KCl、K2SO4、ZnCl2和1LH2O为原料配得相同组成的营养液,所需三种盐的物质的量分别是( )
| A、0.1mol、0.2mol、0.1mol |
| B、0.2mol、0.3mol、0.2mol |
| C、0.1mol、0.5mol、0.2mol |
| D、0.1mol、0.3mol、0.1mol |
已知在一定条件下有CO(g)+H2O(g)?CO2(g)+H2(g),在某一容积为2L的密闭容器中,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=a kJ/mol,反应达平衡后,测得c(CO):c(CO2)=3:2,下列说法正确的是( )
| A、反应放出的热量为0.04a KJ |
| B、平衡时H2O的转化率为40% |
| C、若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
| D、判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表
已知表中t1>t2,下列说法不正确的是( )
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,起始时间容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.40mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| D、温度升至800℃时,若上述反应平衡常数为0.64,则正反应为吸热反应 |
下列有关沉淀溶解平衡的说法中,正确的是( )
| A、在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B、可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| C、在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| D、25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI溶液,有黄色沉淀生成 |
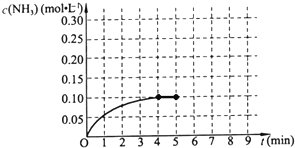 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应: