��Ŀ����
��1��������298K��100kPaʱ����1Lˮ�п��ܽ�0.09mol��ʵ��������ˮ��Cl2Լ������֮һ��ˮ��Ӧ����ش��������⣺
�ٸ÷�Ӧ�����ӷ���ʽΪ ��
�ڹ���÷�Ӧ��ƽ�ⳣ�� ����ʽ���㣩��
��������ƽ����ϵ�м�������NaOH���壬ƽ�⽫�� �ƶ���
���������������ѹǿ��������ˮ�е��ܽ�Ƚ� �����������С�����䡱����ƽ�⽫�� �ƶ���
��2����������һ����Ҫ�����ȼ�ϣ����������������������Գ��������ƻ����ã���ҵ�Ͽ�����ú���������ˮú�����ϳɶ����ѣ���ش��������⣺
������ˮú���ϳɶ����ѵ��ܷ�ӦΪ��
3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g������H=-246.4kJ?mol-1
�����Է�Ϊ��������Ӧ�ֱ����£�4H2��g��+2CO��g���TCH3OCH3��g��+H2O��g������H1=-205.1kJ?mol-1
CO��g��+H2O��g���TCO2��g��+H2��g������H2= ��
����һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬ֻ�ı�һ��������ͬʱ��߷�Ӧ���ʺ�COת���ʵ��� ������ĸ���ţ���
a�������¶� b���������
c����С������� d������H2��Ũ��
e������CO��Ũ��
����һ����ɱ���ܱ������г���3mol H2��3mol CO��1mol CH3OCH3��1mol CO2����һ���¶Ⱥ�ѹǿ�·�����Ӧ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g������һ��ʱ��ﵽƽ�⣬�����ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����
�ʣ�a����Ӧ��ʼʱ�����淴Ӧ���ʵĴ�С��v������ �����������������=����v���棩��
b��ƽ��ʱn��CH3OCH3��= ��ƽ��ʱCO��ת����= ��
�ٸ÷�Ӧ�����ӷ���ʽΪ
�ڹ���÷�Ӧ��ƽ�ⳣ��
��������ƽ����ϵ�м�������NaOH���壬ƽ�⽫��
���������������ѹǿ��������ˮ�е��ܽ�Ƚ�
��2����������һ����Ҫ�����ȼ�ϣ����������������������Գ��������ƻ����ã���ҵ�Ͽ�����ú���������ˮú�����ϳɶ����ѣ���ش��������⣺
������ˮú���ϳɶ����ѵ��ܷ�ӦΪ��
3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g������H=-246.4kJ?mol-1
�����Է�Ϊ��������Ӧ�ֱ����£�4H2��g��+2CO��g���TCH3OCH3��g��+H2O��g������H1=-205.1kJ?mol-1
CO��g��+H2O��g���TCO2��g��+H2��g������H2=
����һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬ֻ�ı�һ��������ͬʱ��߷�Ӧ���ʺ�COת���ʵ���
a�������¶� b���������
c����С������� d������H2��Ũ��
e������CO��Ũ��
����һ����ɱ���ܱ������г���3mol H2��3mol CO��1mol CH3OCH3��1mol CO2����һ���¶Ⱥ�ѹǿ�·�����Ӧ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g������һ��ʱ��ﵽƽ�⣬�����ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����
�ʣ�a����Ӧ��ʼʱ�����淴Ӧ���ʵĴ�С��v������
b��ƽ��ʱn��CH3OCH3��=
���㣺��ѧƽ��ļ���,�Ȼ�ѧ����ʽ,��ѧƽ���Ӱ������,�����Ļ�ѧ����
ר�⣺��ѧƽ��ר��
��������1����������ˮ��Ӧ��������ʹ����ᣬ��������������ʣ�
����1Lˮ�п��ܽ�0.09mol���������������Ѷ�Ϊ0.09mol/L�����ƽ�����ƽ��״̬����Ũ�ȣ�����ƽ�ⳣ���������õ���
�ۼ����������ƣ���Һ�е����������ӣ��������ӷ�Ӧ��ƽ��������У�
�������ܽ����ѹǿ���������ƽ�������������С�ķ�����У�
��2�������ø�˹���ɼ��㣻
�ڸı���������Ӧ���ʣ����Բ�ȡ������������¡���ѹ������Ũ�ȵȴ�ʩ�������CO��ת����Ӧʹƽ��������Ӧ�����ƶ������ƽ���ƶ�ԭ���������
��a��ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����˵����������ܵ����ʵ�����С����Ӧ������Ӧ������У�
b����ƽ��ʱCH3OCH3�����ʵ����仯��Ϊxmol����������ʽ��ʾ��ƽ��ʱ����ֵ����ʵ�������ƽ��ʱ�ܶȿ�֪��ƽ�������������ʵ���Ϊ��ʼʱ��
���ݴ��з��̼�����
����1Lˮ�п��ܽ�0.09mol���������������Ѷ�Ϊ0.09mol/L�����ƽ�����ƽ��״̬����Ũ�ȣ�����ƽ�ⳣ���������õ���
�ۼ����������ƣ���Һ�е����������ӣ��������ӷ�Ӧ��ƽ��������У�
�������ܽ����ѹǿ���������ƽ�������������С�ķ�����У�
��2�������ø�˹���ɼ��㣻
�ڸı���������Ӧ���ʣ����Բ�ȡ������������¡���ѹ������Ũ�ȵȴ�ʩ�������CO��ת����Ӧʹƽ��������Ӧ�����ƶ������ƽ���ƶ�ԭ���������
��a��ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����˵����������ܵ����ʵ�����С����Ӧ������Ӧ������У�
b����ƽ��ʱCH3OCH3�����ʵ����仯��Ϊxmol����������ʽ��ʾ��ƽ��ʱ����ֵ����ʵ�������ƽ��ʱ�ܶȿ�֪��ƽ�������������ʵ���Ϊ��ʼʱ��
| 1 |
| 1.6 |
���
�⣺��1����������ˮ��Ӧ��������ʹ����ᣬ��Ӧ�����ӷ���ʽΪ��Cl2+H2O?H++Cl-+HClO���ʴ�Ϊ��Cl2+H2O?H++Cl-+HClO��
����1Lˮ�п��ܽ�0.09mol��������������Ũ��Ϊ0.09mol/L��
�� Cl2+H2O?H++Cl-+HClO
��ʼŨ�ȣ�0.09 0 0 0
ת��Ũ�ȣ�0.03 0.03 0.03 0.03
ƽ��Ũ�ȣ�0.06 0.03 0.03 0.03
K=
=
=4.5��10-4
�ʴ�Ϊ��4.5��10-4��
��������ƽ����ϵ�м�������NaOH���壬���ƽ��״̬�µ������ӷ�Ӧ��ƽ����������У��ʴ�Ϊ������Ӧ����
��������ƽ���м�ѹ��ƽ�������������С�ķ�Ӧ������У�ƽ�ⶼ������Ӧ�����ƶ����������ܽ��������ӣ��ʴ�Ϊ����������Ӧ����
��2������3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g������H=-246.4kJ?mol-1��
4H2��g��+2CO��g���TCH3OCH3��g��+H2O��g������H1=-205.1kJ?mol-1��
�ɸ�˹���ɿ�֪��ͨ����-��ɵ�����Ӧ����ʽ�����H=-246.4kJ?mol-1+205.1kJ?mol-1=-41.3kJ?mol-1��
�ʴ�Ϊ��-41.3kJ?mol-1��
��2��a������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���CO��ת����������Ӧ���ʼ�С����a����
b�������������Ӧ��������Ӱ��ƽ���ƶ���CO��ת���ʲ��䣬��b����
c������ӦΪ���������С�ķ�Ӧ����С���������ѹǿ����Ӧ��������ƽ��������Ӧ�����ƶ���CO��ת��������c��ȷ��
d������H2��Ũ�ȣ���Ӧ��������ƽ��������Ӧ�ƶ���CO��ת��������d��ȷ��
e������CO��Ũ�ȣ���Ӧ��������ƽ��������Ӧ�ƶ�����CO��ת���ʼ�С����e����
�ʴ�Ϊ��cd��
��a��ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����ͬ��ͬѹ�������С�ܶ���������Ӧ�����������ܵ����ʵ�����С���ʷ�Ӧ������Ӧ������У��ʷ�Ӧ����V��������V���棩���ʴ�Ϊ������
b����ƽ��ʱ�ܶȿ�֪��ƽ�������������ʵ���Ϊ��ʼʱ��
��ƽ��ʱ�����ʵ���Ϊ��3mol+3mol+1mol+1mol����
=5mol��
��ƽ��ʱCH3OCH3�����ʵ����仯��Ϊxmol����
3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g��
��ʼ��mol����3 3 1 1
�仯��mol����3x 3x x x
ƽ�⣨mol����3-3x 3-3x 1+x 1+x
���ԣ�3-3x+3-3x+1+x+1+x=5�����x=0.75
��ƽ��ʱn��CH3OCH3��=1mol+0.75mol=1.75mol��
ƽ��ʱCO��ת����=
��100%=75%��
�ʴ�Ϊ��1.75mol��75%��
����1Lˮ�п��ܽ�0.09mol��������������Ũ��Ϊ0.09mol/L��
�� Cl2+H2O?H++Cl-+HClO
��ʼŨ�ȣ�0.09 0 0 0
ת��Ũ�ȣ�0.03 0.03 0.03 0.03
ƽ��Ũ�ȣ�0.06 0.03 0.03 0.03
K=
| C(H +)C(Cl -)C(HClO) |
| C(Cl 2) |
| 0.03��0.03��0.03 |
| 0.06 |
�ʴ�Ϊ��4.5��10-4��
��������ƽ����ϵ�м�������NaOH���壬���ƽ��״̬�µ������ӷ�Ӧ��ƽ����������У��ʴ�Ϊ������Ӧ����
��������ƽ���м�ѹ��ƽ�������������С�ķ�Ӧ������У�ƽ�ⶼ������Ӧ�����ƶ����������ܽ��������ӣ��ʴ�Ϊ����������Ӧ����
��2������3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g������H=-246.4kJ?mol-1��
4H2��g��+2CO��g���TCH3OCH3��g��+H2O��g������H1=-205.1kJ?mol-1��
�ɸ�˹���ɿ�֪��ͨ����-��ɵ�����Ӧ����ʽ�����H=-246.4kJ?mol-1+205.1kJ?mol-1=-41.3kJ?mol-1��
�ʴ�Ϊ��-41.3kJ?mol-1��
��2��a������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���CO��ת����������Ӧ���ʼ�С����a����
b�������������Ӧ��������Ӱ��ƽ���ƶ���CO��ת���ʲ��䣬��b����
c������ӦΪ���������С�ķ�Ӧ����С���������ѹǿ����Ӧ��������ƽ��������Ӧ�����ƶ���CO��ת��������c��ȷ��
d������H2��Ũ�ȣ���Ӧ��������ƽ��������Ӧ�ƶ���CO��ת��������d��ȷ��
e������CO��Ũ�ȣ���Ӧ��������ƽ��������Ӧ�ƶ�����CO��ת���ʼ�С����e����
�ʴ�Ϊ��cd��
��a��ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����ͬ��ͬѹ�������С�ܶ���������Ӧ�����������ܵ����ʵ�����С���ʷ�Ӧ������Ӧ������У��ʷ�Ӧ����V��������V���棩���ʴ�Ϊ������
b����ƽ��ʱ�ܶȿ�֪��ƽ�������������ʵ���Ϊ��ʼʱ��
| 1 |
| 1.6 |
| 1 |
| 1.6 |
��ƽ��ʱCH3OCH3�����ʵ����仯��Ϊxmol����
3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g��
��ʼ��mol����3 3 1 1
�仯��mol����3x 3x x x
ƽ�⣨mol����3-3x 3-3x 1+x 1+x
���ԣ�3-3x+3-3x+1+x+1+x=5�����x=0.75
��ƽ��ʱn��CH3OCH3��=1mol+0.75mol=1.75mol��
ƽ��ʱCO��ת����=
| 0.75mol��3 |
| 3mol |
�ʴ�Ϊ��1.75mol��75%��
���������⿼�鷴Ӧ�ȼ��㡢��ѧƽ��Ӱ�����ء���ѧƽ�����ȣ��Ѷ��еȣ���2������ע���ж���ʼ��ƽ��ʱ������������ʵ�����ϵ��

��ϰ��ϵ�д�
�����Ŀ
�������������У�������һ����ɵ�ֲ��Ӫ��Һ����֪ijֲ��Ӫ��Һ���䷽Ϊ0.3molKCl��0.2molK2SO4��0.1molZnSO4��1LH2O������KCl��K2SO4��ZnCl2��1LH2OΪԭ�������ͬ��ɵ�Ӫ��Һ�����������ε����ʵ����ֱ��ǣ�������
| A��0.1mol��0.2mol��0.1mol |
| B��0.2mol��0.3mol��0.2mol |
| C��0.1mol��0.5mol��0.2mol |
| D��0.1mol��0.3mol��0.1mol |
�����йس����ܽ�ƽ���˵���У���ȷ���ǣ�������
| A����AgCl�ij����ܽ�ƽ����ϵ�У���������ˮ��Ksp��AgCl������ |
| B����ֱ�Ӹ���Ksp����ֵ��С�Ƚ���������ˮ�е��ܽ�ȴ�С |
| C����CaCO3�ij����ܽ�ƽ����ϵ�У�����ϡ���ᣬƽ�ⲻ�ƶ� |
| D��25��ʱ��Ksp��AgCl����Ksp��AgI������AgCl������Һ�м���KI��Һ���л�ɫ�������� |
���������ֳư�������أ���䡢�ŵ簴��ʽ���У�Fe+Ni2O3+3H2O
Fe��OH��2+2Ni��OH��2�������йظõ�ص�˵������ȷ���ǣ�������
| �ŵ� |
| ��� |
| A����صĵ��ҺΪ������Һ������ΪNi2O3������ΪFe |
| B����طŵ�ʱ��������ӦΪFe+2OH--2e-=Fe��OH��2 |
| C����س������У�����������Һ��pH���� |
| D����س��ʱ��������ӦΪ2Ni��OH��2+2OH--2e-=Ni2O3+3H2O |
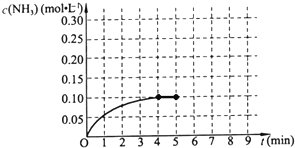 ��һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��
��һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��