题目内容
19.铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.回答下列问题:①铜原子基态电子排布式为1s22s22p63s23p63d104s1;
②用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm.又知铜的密度为9.00g•cm-3,则阿伏加德罗常数为63.6g•mol-1=$\frac{1}{4}$×4.23×10-22g×NA,得NA=6.01×1023mol-1(列式计算,结果保留三位有效数字)
分析 ①铜是29号元素,根据核外电子排布规律书写;
②根据晶胞的棱长a,其体积为a3;晶胞的质量=体积×密度;
铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子,故铜的摩尔质量=$\frac{1}{4}$×晶胞质量×NA,据此计算NA;
解答 解:①铜是29号元素,其基态原子的电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
②1pm=10-10cm,故一个晶胞的体积为(361×10-10cm)3=4.7×10-23cm3;晶胞的质量=体积×密度,故一个晶胞的质量为4.7×10-23cm3×9.00g•cm-3=4.23×10-22g;铜的晶胞为面心立方最密堆积,一个晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故铜的摩尔质量=$\frac{1}{4}$×晶胞质量×NA,所以63.6g•mol-1=$\frac{1}{4}$×4.23×10-22g×NA,得NA=6.01×1023mol-1,
故答案为:63.6g•mol-1=$\frac{1}{4}$×4.23×10-22g×NA,得NA=6.01×1023mol-1.
点评 本题以铜元素及其化合物为载体,综合电子排布和阿伏加德罗常数的主干知识,题目难度较大.

练习册系列答案
相关题目
10.下列各溶液与强酸溶液反应,不能用离子方程式HCO3-+H+=CO2↑+H2O 表示的是( )
| A. | 碳酸氢钾溶液 | B. | 纯碱溶液 | C. | 碳酸氢钙溶液 | D. | 小苏打溶液 |
7.乙炔分子CH≡CH加成可以得到CH2═CH-C≡CH(乙烯基乙炔),该物质是合成橡胶的重要原料.下列对该物质的判断中错误的是( )
| A. | 该物质与足量的H2加成后,只能生成一种物质 | |
| B. | 该物质既是CH2═CH2的同系物,又是CH≡CH的同系物 | |
| C. | 该物质既能使酸性KMnO4溶液褪色,又能使溴水褪色 | |
| D. | 该物质经加成,加聚后产物是氯丁橡胶(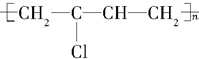 )的主要成分 )的主要成分 |
14.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | Cl03- 的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32- 的中心原子均为sp3杂化 |
11.氯有两种稳定的天然同位素37Cl、35Cl,已知它们的原子个数之比为3:1,则氯的相对分之质量为70、72、74的三种氯气分子的物质的量之比为( )
| A. | 6:6:1 | B. | 6:3:1 | C. | 3:3:1 | D. | 9:3:1 |
9.下列反应中,不属于取代反应的是( )
| A. | 在催化剂存在条件下苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 葡萄糖与银氨溶液反应 |
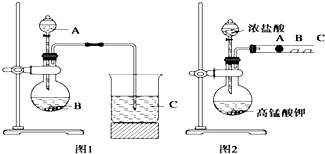 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答: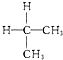 与
与 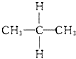
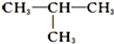
 ;
;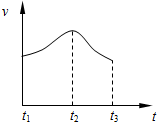 把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.
把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.