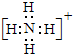题目内容
14.下列描述中正确的是( )| A. | CS2为V形的极性分子 | |
| B. | Cl03- 的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32- 的中心原子均为sp3杂化 |
分析 A.结构不对称,正负电荷的中心不重合,为极性分子,反之为非极性分子,CS2为直线型分子;
B.根据价层电子对互斥理论分析;
C.SF6中S-F含有一个成键电子对;
D.先求出中心原子的价层电子对数,再判断杂化类型.
解答 解:A.CS2含有C=S极性键,CS2的结构为S=C=S,分子为线型结构,结构对称,正负电荷的中心重合,为非极性分子,故A错误;
B.ClO3-中Cl的价层电子对数=3+$\frac{1}{2}$(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
C.SF6中S-F含有一个成键电子对,所以SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,故C正确;
D.SiF4中Si的价层电子对数=4+$\frac{1}{2}$(4-1×4)=4,SO32-中Si的价层电子对数=3+$\frac{1}{2}$(6+2-2×3)=4,所以中心原子均为sp3杂化,故D正确.
故选CD.
点评 本题考查微粒的构型、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
3.下列说法错误的是( )
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
2.可以证明可逆反应N2+3H2?2NH3已达平衡状态的是:①一个N≡N键断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体的平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤ω(NH3)、ω(N2)和ω(H2)都不再改变;⑥恒温恒容时,密度保持不变;⑦v正(H2)=0.03mol•L-1•min-1,v逆(NH3)=0.02mol•L-1•min-1( )
| A. | 全部 | B. | ②③④⑤⑥⑦ | C. | ②③④⑤⑦ | D. | 只有③④⑤⑥⑦ |
3.下列说法正确的是( )
| A. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| B. | 分子式为C5H12O且氧化产物能发生银镜反应的醇有6种 | |
| C. | 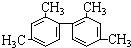 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 1mol β-紫罗兰酮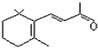 与1mol H2发生加成反应可得到3种不同产物 与1mol H2发生加成反应可得到3种不同产物 |
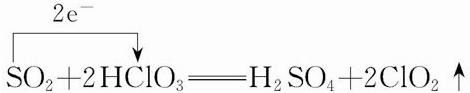 .
.